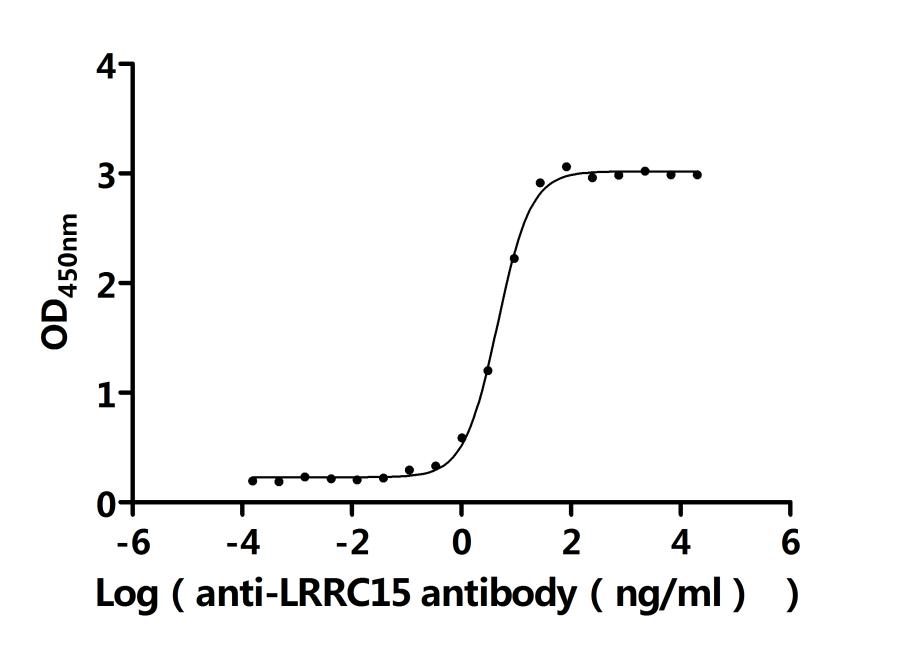
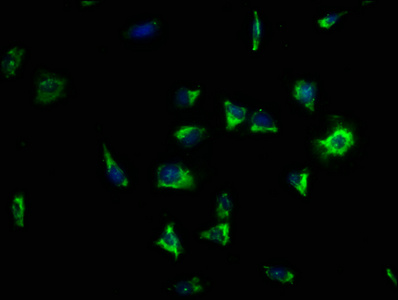
靶向LRRC15:從腫瘤微環(huán)境調(diào)控到纖維化/感染性疾病治療
日期:2025-06-20 10:03:19
LRRC15(富含亮氨酸重復(fù)序列蛋白 15)作為跨膜蛋白,在腫瘤微環(huán)境調(diào)控、病毒感染機制及纖維化疾病中具有重要作用。本文系統(tǒng)闡述了LRRC15的分子結(jié)構(gòu)、表達調(diào)控、信號通路參與機制及其在相關(guān)疾病中的病理功能,并總結(jié)靶向藥物開發(fā)進展,為相關(guān)機制及臨床研究提供參考。
1. 關(guān)于LRRC15
1.1 LRRC15的分子結(jié)構(gòu)與表征
LRRC15是I型跨膜蛋白,編碼基因位于人類染色體3q29,胞外域含15個亮氨酸重復(fù)序列(LRRs),形成馬蹄形結(jié)構(gòu),介導(dǎo)蛋白-蛋白相互作用;跨膜域緊鄰胞外域,胞內(nèi)域較短 [1,2]。正常生理條件下,LRRC15主要表達于胎盤滋養(yǎng)層細胞、毛囊、扁桃體、胃黏膜等組織,病理狀態(tài)下在腫瘤相關(guān)成纖維細胞(CAFs)及纖維化組織中顯著上調(diào),其表達受TGF-β、IL-1β等細胞因子調(diào)控 [3,4]。

圖1. LRRC15蛋白的結(jié)構(gòu) [7]
1.2 LRRC15的生物學(xué)功能
LRRC15通過結(jié)合纖連蛋白和β1整合素,促進腫瘤細胞黏附、遷移和侵襲 [3]。在間充質(zhì)干細胞(MSCs)中,LRRC15與轉(zhuǎn)錄因子TWIST1協(xié)同調(diào)控干細胞干性,LRRC15+ MSCs表現(xiàn)出更強的增殖能力和治療潛力 [4]。
2. LRRC15的作用機制
2.1 腫瘤微環(huán)境調(diào)控
LRRC15主要表達于CAFs,通過重塑細胞外基質(zhì)(ECM)和調(diào)節(jié)免疫微環(huán)境促進腫瘤進展。單細胞RNA測序顯示,LRRC15+ CAFs在胰腺導(dǎo)管腺癌、卵巢癌中高表達膠原及免疫抑制因子,與免疫檢查點抑制劑響應(yīng)不佳相關(guān) [3,5]。機制上,LRRC15激活黏著斑激酶(FAK)/Src信號通路,促進卵巢癌細胞遷移 [6];同時通過Wnt/β-catenin通路調(diào)控乳腺癌細胞侵襲 [3]。
2.2 病毒感染與免疫調(diào)節(jié)
LRRC15作為SARS-CoV-2 spike蛋白的輔助受體,與ACE2協(xié)同促進病毒入侵,但LRRC15+成纖維細胞也可通過隔離病毒顆粒抑制感染擴散 [7-9]。結(jié)構(gòu)研究表明,LRRC15與spike蛋白S1亞基結(jié)合親和力為68.8 nM,低于ACE2的11.6 nM [7]。此外,LRRC15+ CAFs分泌TGF-β和IL-10,抑制T細胞功能,形成免疫抑制微環(huán)境 [3,10]。
2.3 纖維化調(diào)控
在博來霉素誘導(dǎo)的肺纖維化模型中,LRRC15+ MSCs移植可降低膠原沉積,其機制與抑制TGF-β/Smad信號通路相關(guān) [4]。在骨關(guān)節(jié)炎的髕下脂肪墊纖維化中,LRRC15高表達促進成纖維細胞活化和膠原合成 [11]。
3. LRRC15相關(guān)信號通路
3.1 TGF-β信號通路
TGF-β通過Smad2/3磷酸化誘導(dǎo)LRRC15轉(zhuǎn)錄,LRRC15反過來結(jié)合TGF-β受體,延長信號傳導(dǎo),促進膠原基因(如COL1A1)表達 [3,4]。
3.2 FAK/Src信號通路
LRRC15與整合素β1結(jié)合后激活FAK Tyr397磷酸化,招募Src家族激酶,激活PI3K/AKT和MAPK通路,驅(qū)動細胞遷移 [3]。骨肉瘤細胞中,抑制LRRC15可降低FAK磷酸化水平 [12]。
3.3 TWIST1-LRRC15軸
在MSCs中,TWIST1直接結(jié)合LRRC15啟動子調(diào)控其表達。TWIST1過表達增加LRRC15+ MSCs比例,這些細胞高表達干細胞標(biāo)記(如ID1、BMI1)和治療性細胞因子(如IL-1RA)[4]。
4. LRRC15相關(guān)疾病
4.1 惡性腫瘤
4.1.1 肉瘤
LRRC15在軟組織肉瘤(如未分化多形性肉瘤、骨肉瘤)中高表達,靶向LRRC15的抗體-藥物偶聯(lián)物(ADC)在肉瘤模型中誘導(dǎo)腫瘤消退,I期臨床試驗顯示骨肉瘤患者客觀緩解率達20% [3,12,13]。
4.1.2 卵巢癌
LRRC15在卵巢癌CAFs中高表達,敲低LRRC15可減少腹腔轉(zhuǎn)移。機制上,LRRC15通過FAK信號促進癌細胞與腹膜間皮黏附 [6]。
4.1.3 其他實體瘤
LRRC15在膠質(zhì)母細胞瘤中與腫瘤侵襲性負相關(guān) [5],在肺腺癌中高表達與5年生存率改善相關(guān) [1]。
4.2 纖維化疾病
4.2.1 肺纖維化
COVID-19患者肺組織中LRRC15+成纖維細胞增多,移植LRRC15+ MSCs可減輕博來霉素誘導(dǎo)的肺纖維化 [4,7]。
4.2.2 骨關(guān)節(jié)炎
骨關(guān)節(jié)炎患者髕下脂肪墊中LRRC15+成纖維細胞比例增加,促進纖維化進程 [11]。
4.3 病毒感染性疾病
LRRC15參與SARS-CoV-2入侵,但過表達可隔離病毒顆粒;多組學(xué)研究顯示LRRC15水平下降與COVID-19重癥相關(guān) [7,14]。
5. 靶向LRRC15的藥物研究進展
目前,靶向LRRC15的藥物研究尚處于早期,多款A(yù)DC藥物處于臨床前研究階段,適應(yīng)癥以腫瘤為主;另有融合蛋白、雙特異性T細胞接合器等藥物類型管線在研。部分列舉如下表:
| 藥物 | 作用機制 | 藥物類型 | 在研適應(yīng)癥(疾病名) | 在研機構(gòu) | 最高研發(fā)階段 |
| LRRC15-IFNα | IFNAR激動劑 | LRRC15抑制劑 | 融合蛋白 | 腫瘤 | Bonum Therapeutics, Inc. | 臨床前 |
| LNTH-2403 | LRRC15抑制劑 | 放射與診斷藥物 | 骨肉瘤 | 實體瘤 | Lantheus Holdings, Inc. | 臨床前 |
| SOT-106 | LRRC15抑制劑 | 微管蛋白抑制劑 | ADC | 晚期惡性實體瘤 | 肉瘤 | 實體瘤 | SOTIO Biotech as | Excoso as | 臨床前 |
| H02L0-V1-PBD | LRRC15抑制劑 | ADC | 腫瘤 | Daiichi Sankyo Co., Ltd. | 臨床前 |
| ZL-6201 | LRRC15抑制劑 | TOP1抑制劑 | ADC | 軟骨肉瘤 | 實體瘤 | 再鼎醫(yī)藥(上海)有限公司 | Zai Lab Ltd. | Zai Lab Ltd. (United States) | 臨床前 |
| LRRC15 NovaTE(NovaRock Biotherapeutics) | CD3刺激劑 | LRRC15抑制劑 | 雙特異性T細胞結(jié)合器 | 肉瘤 | 實體瘤 | Novarock Biotherapeutics Ltd. | 臨床前 |
| LRRC15-antiTGFβR2 | LRRC15抑制劑 | TGF-β抑制劑 | 融合蛋白 | 腫瘤 | Bonum Therapeutics, Inc. | 臨床前 |
6. LRRC15相關(guān)產(chǎn)品推薦
LRRC15在腫瘤、病毒感染及纖維化疾病中具有多重調(diào)控作用,其在CAFs和MSCs中的特異性表達使其成為潛在治療靶點。華美生物提供多種屬LRRC15高活性重組蛋白及高特異性抗體,助您深入研究LRRC15的細胞來源與信號網(wǎng)絡(luò),開發(fā)精準(zhǔn)靶向策略,探索其作為生物標(biāo)志物的臨床價值。
參考文獻:
[1] Woon JYX, et al. Association of LRRC15 protein expression with 5-year survival in lung adenocarcinoma patients. Annals of Oncology. 2024.
[2] Purcell JW, et al. LRRC15 is a novel mesenchymal protein and stromal target for antibody-drug conjugates. Cancer Res. 2018.
[3] Ray U, et al. Exploiting LRRC15 as a Novel Therapeutic Target in Cancer. Cancer Res. 2022.
[4] Toriumi K, et al. LRRC15 expression indicates high level of stemness regulated by TWIST1 in mesenchymal stem cells. iScience. 2023.
[5] Dominguez CX, et al. Single-cell RNA sequencing reveals stromal evolution into LRRC15+ myofibroblasts as a determinant of patient response to cancer immunotherapy. Cancer Discov. 2020.
[6] Ray U, et al. Targeting LRRC15 inhibits metastatic dissemination of ovarian cancer. Cancer Res. 2021.
[7] Loo L, et al. Fibroblast-expressed LRRC15 is a receptor for SARS-CoV-2 spike and controls antiviral and antifibrotic transcriptional programs. PLoS Biol. 2023.
[8] Song J, et al. LRRC15 inhibits SARS-CoV-2 cellular entry in trans. PLoS Biol. 2022.
[9] Shilts J, et al. LRRC15 mediates an accessory interaction with the SARS-CoV-2 spike protein. bioRxiv. 2021.
[10] Krishnamurty AT, et al. LRRC15+ myofibroblasts dictate the stromal setpoint to suppress tumour immunity. Nature. 2022.
[11] Potential Role Of Lrrc15-Expressing Fibroblasts In Infrapatellar Fat Pad Fibrosis In Knee Osteoarthritis.
[12] Slemmons KK, et al. LRRC15 antibody-drug conjugates show promise as osteosarcoma therapeutics in preclinical studies. Pediatr Blood Cancer. 2021.
[13] Ben-Ami E, et al. LRRC15 Targeting in Soft-Tissue Sarcomas: Biological and Clinical Implications. Cancers. 2020.
[14] Gisby JS, et al. Multi-omics identify falling LRRC15 as a COVID-19 severity marker and persistent pro-thrombotic signals in convalescence. Nat Commun. 2022.