【第58期】前沿靶點速遞:每周醫(yī)學(xué)研究精選
日期:2025-10-10 15:46:56
01、靶點:SLC45A4
應(yīng)用:靶向SLC45A4的鎮(zhèn)痛療法
來源:SLC45A4 is a pain gene encoding a neuronal polyamine transporter.Nature,2025 Aug 20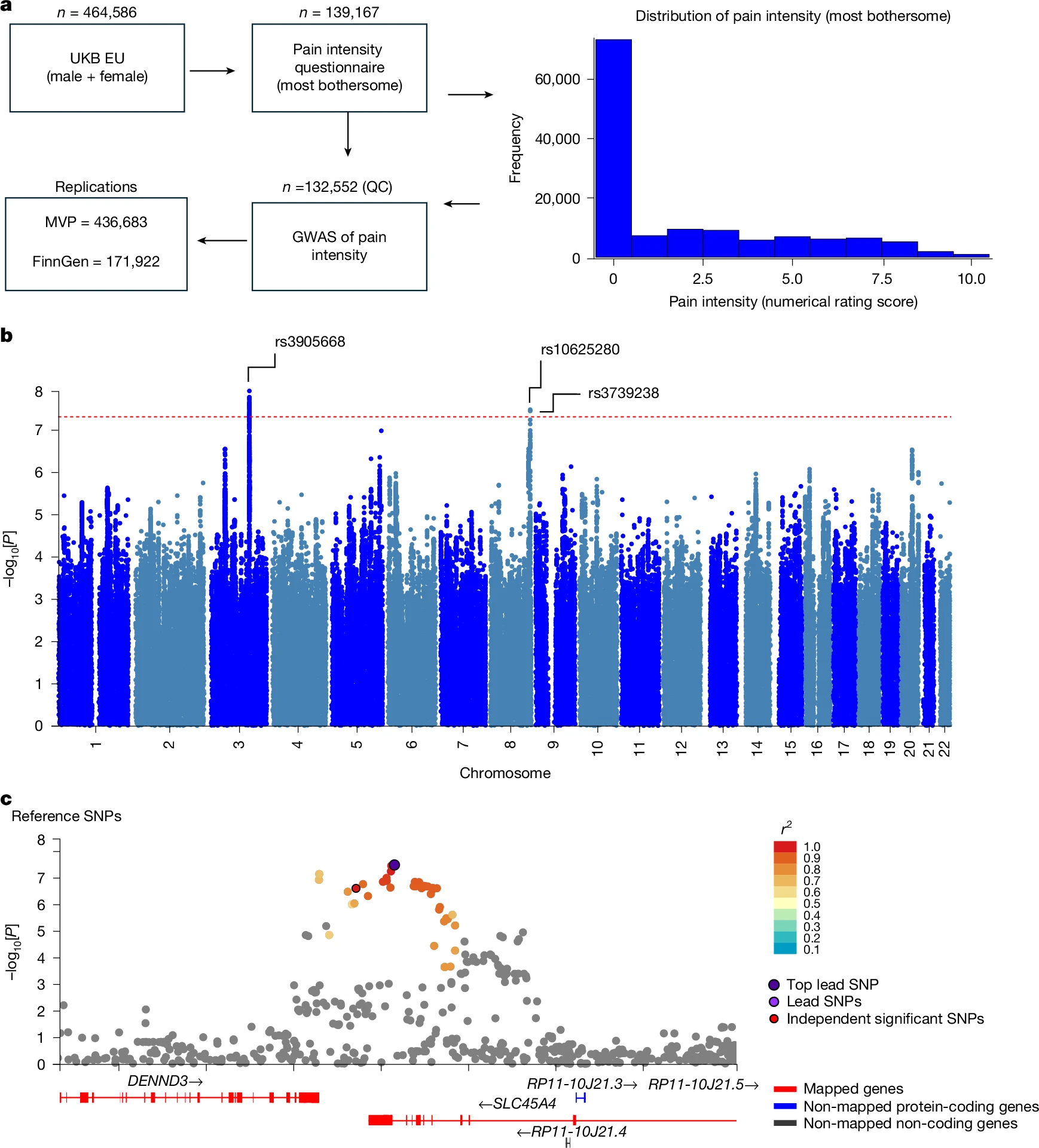
2025年8月20日,由牛津大學(xué)David L. Bennett和Simon Newstead教授共同領(lǐng)導(dǎo)的團(tuán)隊在《Nature》發(fā)表研究論文,揭示神經(jīng)元特異性多胺轉(zhuǎn)運蛋白SLC45A4作為重要疼痛基因的關(guān)鍵作用。通過英國生物樣本庫(UK Biobank)的全基因組關(guān)聯(lián)分析(GWAS),研究首次發(fā)現(xiàn)SLC45A4基因座變異與人類慢性疼痛強度顯著相關(guān)。機制研究表明,SLC45A4在背根神經(jīng)節(jié)感覺神經(jīng)元(包括傷害性感受器)中高度表達(dá),其冷凍電鏡結(jié)構(gòu)揭示了一個獨特的調(diào)控結(jié)構(gòu)域和多胺識別位點。功能實驗證實SLC45A4是選擇性質(zhì)膜多胺轉(zhuǎn)運體,調(diào)控多胺穩(wěn)態(tài)。基因敲除小鼠表現(xiàn)為傷害性熱敏感性和化學(xué)致痛反應(yīng)降低,與C多模式傷害性感受器興奮性下降相關(guān)。該研究不僅揭示了多胺轉(zhuǎn)運在疼痛感知中的新機制,還為開發(fā)靶向SLC45A4的鎮(zhèn)痛療法提供了重要理論依據(jù)和轉(zhuǎn)化前景。
02、靶點:RBPMS、RBPMS2
應(yīng)用:心肌病與先天性心臟病的治療
來源:RBPMS and RBPMS2 Cooperate to Safeguard Cardiac Splicing.Circ Res,2025 Sep 12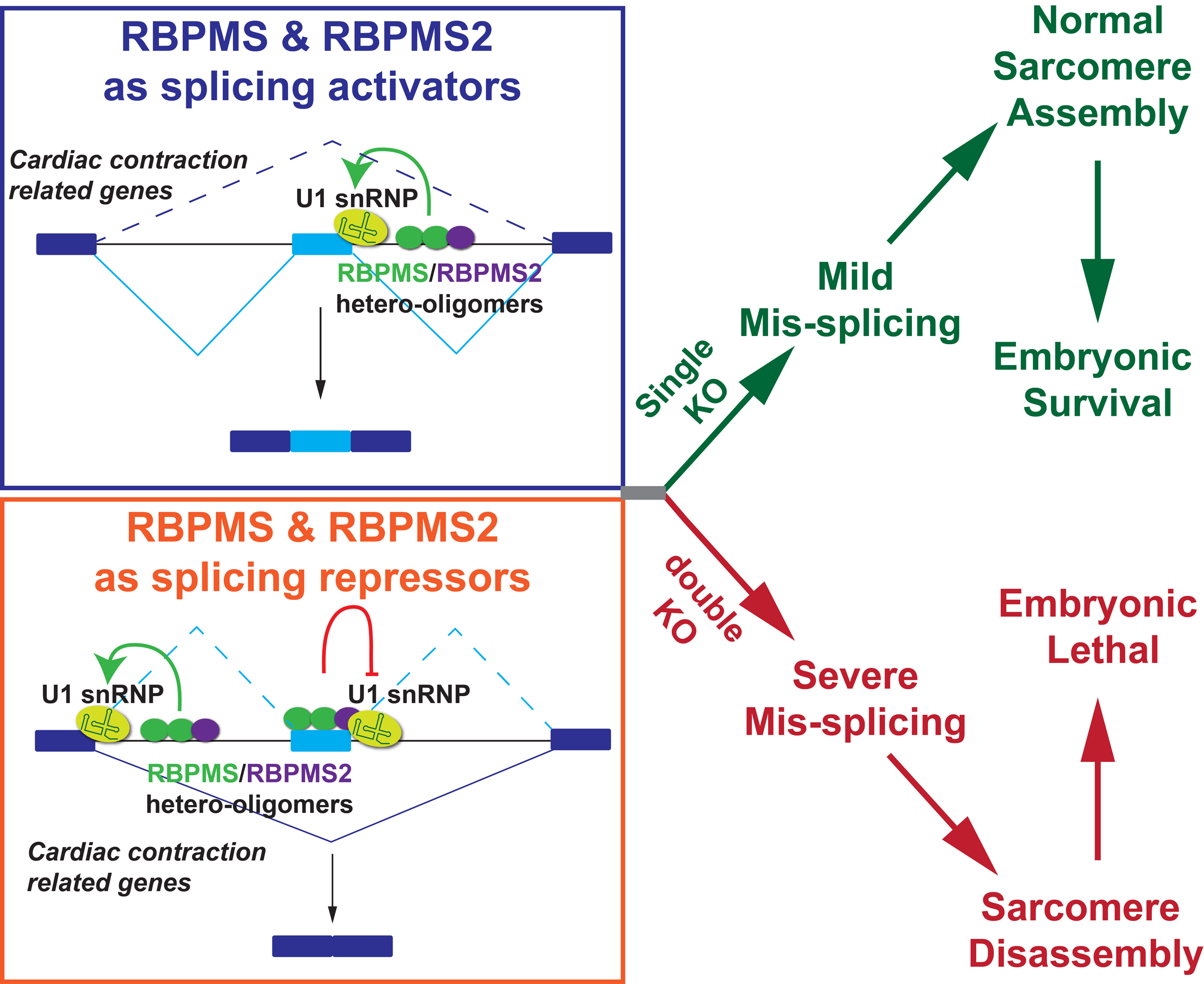
2025年8月27日,美國梅森醫(yī)學(xué)研究所吳同彬團(tuán)隊和加州大學(xué)圣地亞哥分校陳炬團(tuán)隊合作于《Circulation Research》在線發(fā)表研究論文。研究揭示了RBPMS與RBPMS2兩種心臟剪接因子在維持心臟特有剪接模式和肌小節(jié)結(jié)構(gòu)中的協(xié)作機制。利用CRISPR-Cas9技術(shù)構(gòu)建小鼠模型,發(fā)現(xiàn)單敲除RBPMS會導(dǎo)致左心室壁致密化不足及輕度心功能異常,雙敲除則會導(dǎo)致胚胎早期死亡和嚴(yán)重的心臟結(jié)構(gòu)缺陷。RNA測序分析顯示,兩種蛋白協(xié)同調(diào)控關(guān)鍵外顯子的剪接,共同維持心臟特有的剪接特征。研究為理解心肌病與先天性心臟病的分子基礎(chǔ)提供了新視角,并為未來分子干預(yù)治療心臟疾病提供了關(guān)鍵突破口。
03、靶點:SLC38A2
應(yīng)用:開發(fā)新型降壓藥物
來源:Inhibiting SLC38A2 lowers blood pressure in rodent models of hypertension.Sci Transl Med,2025 Sep 03

2025年9月3日,華東師范大學(xué)張曉燕教授團(tuán)隊聯(lián)合大連醫(yī)科大學(xué)管又飛教授和華中科技大學(xué)同濟醫(yī)院汪道文教授團(tuán)隊,在《Science Translational Medicine》發(fā)表研究論文,揭示血管內(nèi)皮氨基酸轉(zhuǎn)運體SLC38A2在血壓調(diào)控中的關(guān)鍵作用。研究發(fā)現(xiàn),SLC38A2在高鹽飲食誘導(dǎo)的高血壓大鼠主動脈內(nèi)皮細(xì)胞中顯著上調(diào)。內(nèi)皮細(xì)胞特異性敲除Slc38a2的小鼠基礎(chǔ)血壓顯著降低,且對高鹽飲食及DOCA鹽誘導(dǎo)的高血壓有抵抗能力。機制上,SLC38A2缺失導(dǎo)致細(xì)胞內(nèi)谷氨酰胺水平降低,激活A(yù)KT-eNOS信號通路,增加NO生成,促進(jìn)血管舒張。此外,SLC38A2的小分子抑制劑MeAIB在動物模型中也展現(xiàn)出顯著的降壓效果。該研究為開發(fā)新型降壓藥物提供了全新靶點。
04、靶點:FOXQ1
應(yīng)用:相關(guān)神經(jīng)疾病研究
來源:FOXQ1 Regulates Brain Endothelial Mitochondrial Function by Orchestrating Calcium Signaling and Cristae Morphology.Adv Sci (Weinh),
2025 Aug 30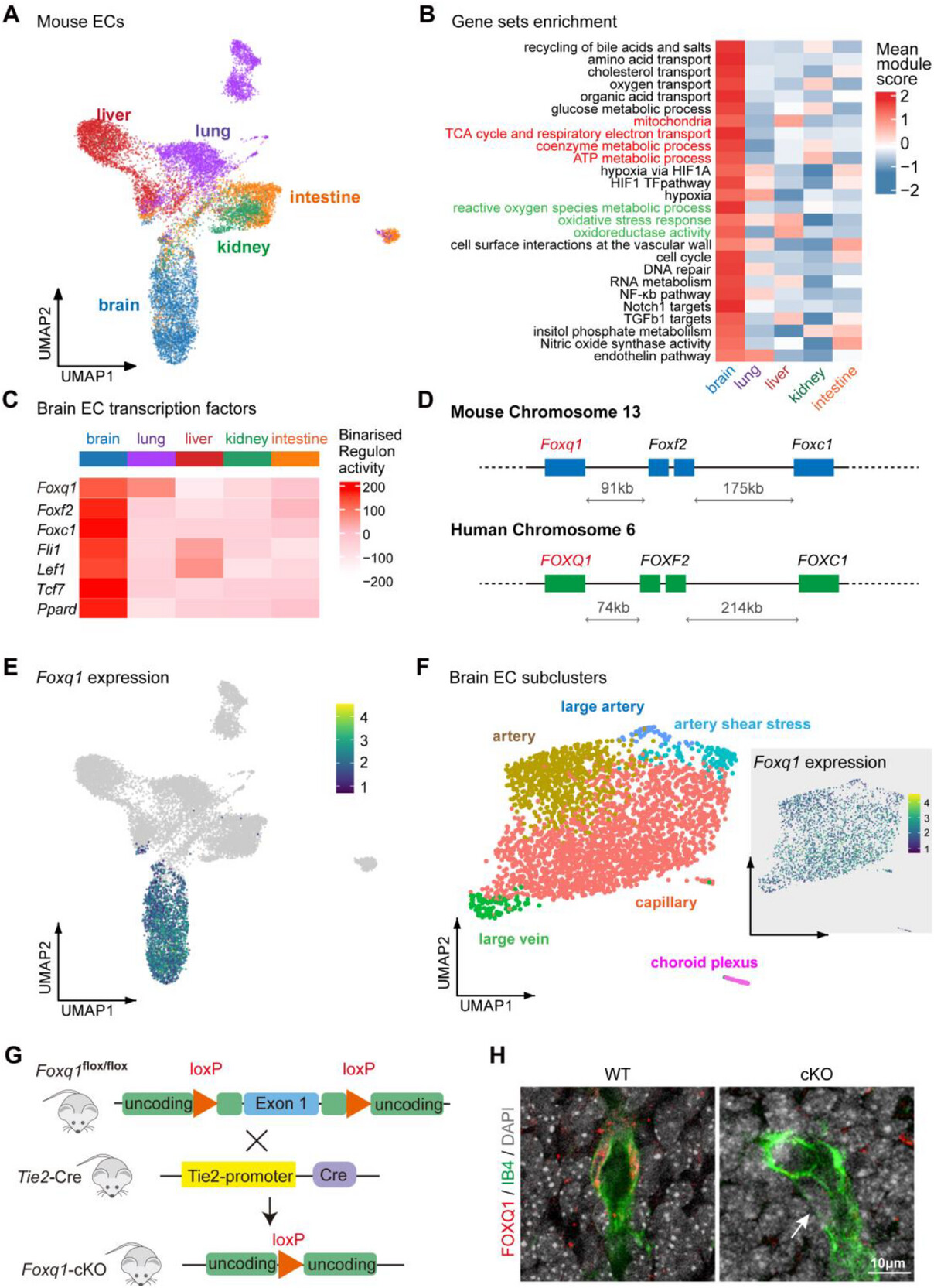
2025年8月30日,廣東醫(yī)科大學(xué)附屬醫(yī)院張晶晶團(tuán)隊與中國科學(xué)院動物研究所焦建偉團(tuán)隊合作在《Advanced Science》發(fā)表論文,揭示轉(zhuǎn)錄因子FOXQ1是調(diào)控腦內(nèi)皮細(xì)胞線粒體功能的關(guān)鍵因子。研究發(fā)現(xiàn),腦內(nèi)皮細(xì)胞不僅依賴糖酵解供能,更需要高效的氧化磷酸化滿足大腦高能量需求。FOXQ1缺失會導(dǎo)致腦內(nèi)皮細(xì)胞線粒體結(jié)構(gòu)異常、功能崩潰,細(xì)胞啟動代謝應(yīng)急,但仍無法滿足能量需求。該研究顛覆了內(nèi)皮細(xì)胞代謝的傳統(tǒng)認(rèn)知,為理解神經(jīng)疾病中的腦血管功能異常提供了新視角。
05、靶點:ACACA、LSS
應(yīng)用:胃癌治療
來源:A combined enteric neuron-gastric tumor organoid reveals metabolic vulnerabilities in gastric cancer.Cell Stem Cell,2025 Oct 02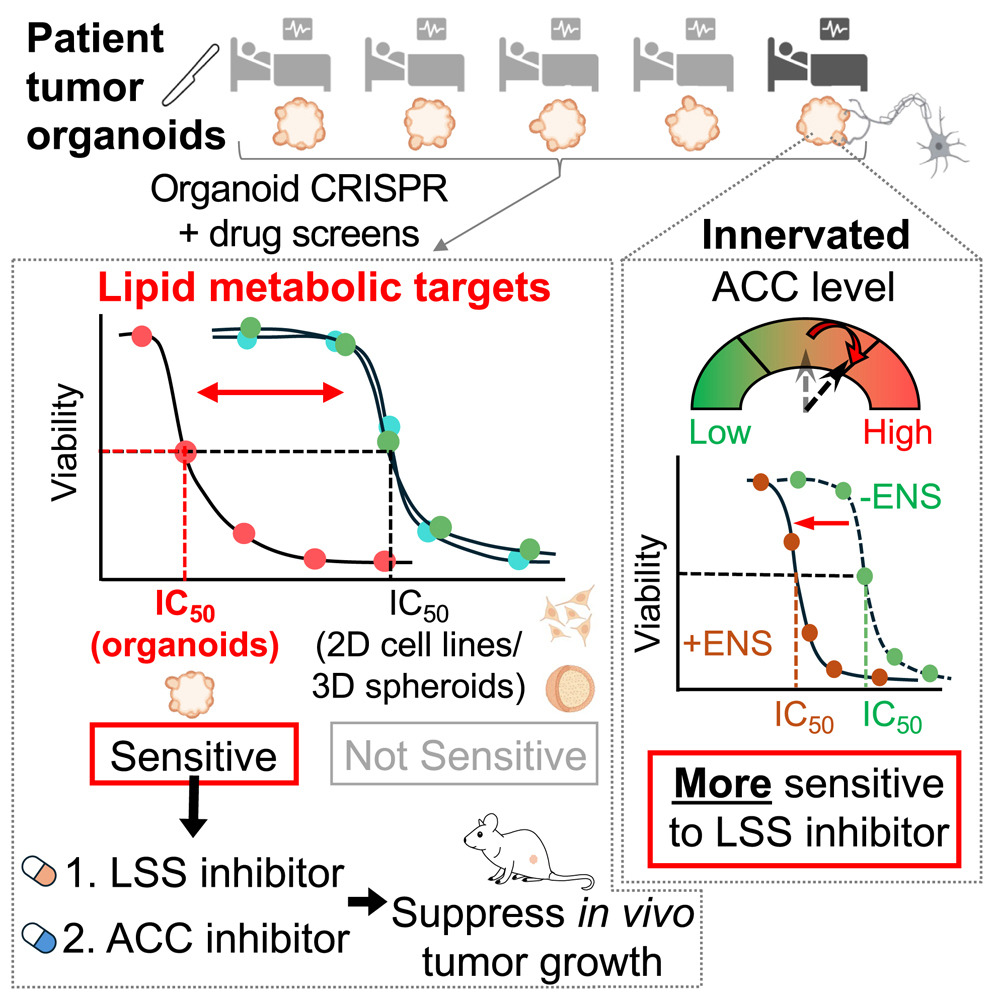
2025年9月2日,香港大學(xué)李嘉誠醫(yī)學(xué)院黃兆麟團(tuán)隊在《Cell Stem Cell》發(fā)表研究,揭示胃癌細(xì)胞與腸神經(jīng)元之間的動態(tài)互動及其代謝調(diào)控機制。研究開發(fā)了腸神經(jīng)元-胃癌類器官共同培養(yǎng)模型,通過CRISPR-Cas9高通量基因篩選,發(fā)現(xiàn)ACACA和LSS兩個關(guān)鍵脂質(zhì)代謝因子對癌細(xì)胞生存至關(guān)重要。小鼠實驗顯示,阻斷這些因子可減緩腫瘤生長。研究還發(fā)現(xiàn),腸神經(jīng)元的存在使胃癌細(xì)胞對脂質(zhì)代謝抑制劑更敏感,為胃癌治療提供了潛在的新靶點和生物標(biāo)記物,有望推動個性化治療的發(fā)展。
06、靶點:ZBP1
應(yīng)用:阿爾茨海默病(AD)治療
來源:Innate immune sensing of Z-nucleic acids by ZBP1-RIPK1 axis drives neuroinflammation in Alzheimer's disease.Immunity,2025 Aug 25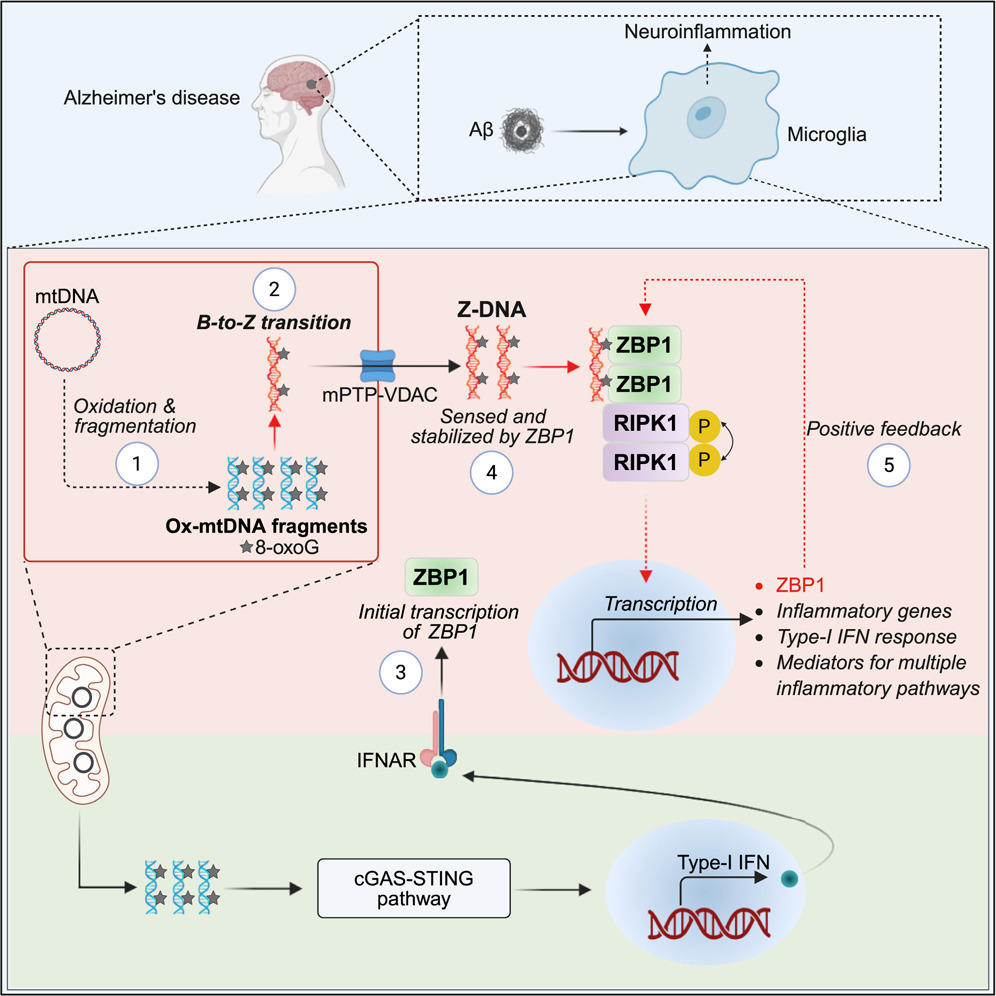
2025年9月2日,中科院上海有機化學(xué)研究所許代超團(tuán)隊在《Immunity》發(fā)表研究,揭示氧化型Z型線粒體DNA(Z-mtDNA)作為ZBP1的新型內(nèi)源性配體,可驅(qū)動小膠質(zhì)細(xì)胞介導(dǎo)的神經(jīng)炎癥。在阿爾茨海默病(AD)病理環(huán)境下,氧化應(yīng)激導(dǎo)致mtDNA斷裂并形成Z-DNA,被ZBP1識別后激活RIPK1,促進(jìn)多條促炎通路,導(dǎo)致神經(jīng)炎癥和AD病理變化。在AD模型中,敲除ZBP1或抑制RIPK1活性可顯著緩解神經(jīng)炎癥和病理缺陷。這一發(fā)現(xiàn)為AD神經(jīng)免疫調(diào)控機制提供了新視角,為治療AD提供了潛在靶點。
07、靶點:IP6K2
應(yīng)用:炎癥性腸癌的治療
來源:Hongyun Zhang et al. Oncometabolite 5-IP7 inhibits inositol 5-phosphatase to license E-cadherin endocytosis.Nat Chem Biol,2025 Aug 26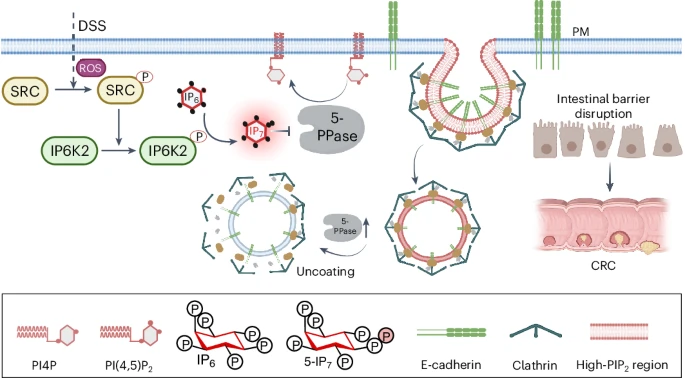
2025年9月2日,南方科技大學(xué)饒楓團(tuán)隊在《Nature Chemical Biology》發(fā)表研究,揭示IP6K2及其產(chǎn)物5-IP7在炎癥性結(jié)直腸癌中的作用機制。研究發(fā)現(xiàn),IP6K2在結(jié)直腸癌組織中高表達(dá),與患者生存率負(fù)相關(guān)。5-IP7通過抑制5-磷酸酶OCRL活性,導(dǎo)致PI(4,5)P2累積,促進(jìn)E-鈣黏蛋白內(nèi)吞,破壞腸上皮屏障,激活β-連環(huán)蛋白致癌通路。團(tuán)隊還篩選出IP6K2抑制劑異鼠李素,可顯著降低結(jié)腸癌腫瘤數(shù)量和體積,為炎癥性腸癌的治療提供了新靶點和潛在藥物。
08、靶點:TCF25
應(yīng)用:缺血性疾病的潛在治療靶點
來源:TCF25 serves as a nutrient sensor to orchestrate metabolic adaptation and cell death by enhancing lysosomal acidification under glucose starvation.Cell Rep,2025 Sep 23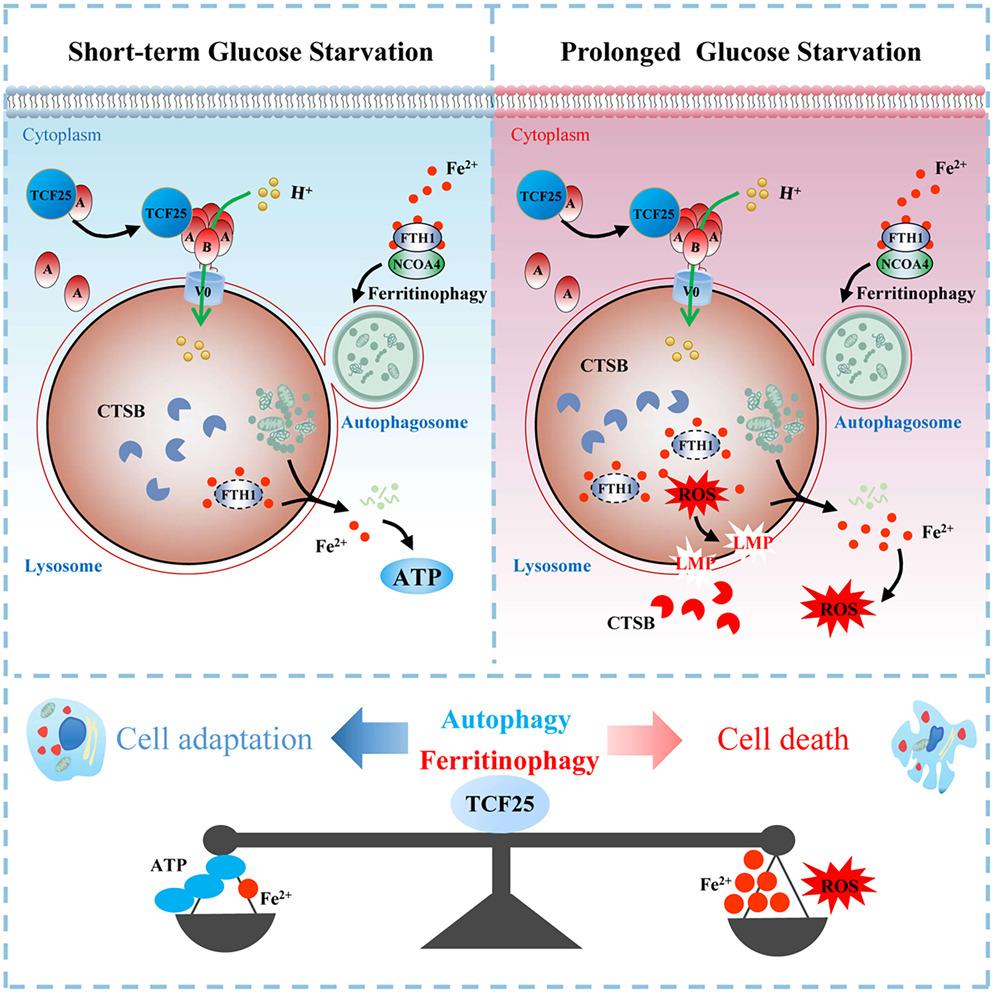
2025年9月2日,同濟大學(xué)蔡振宇課題組在《Cell Reports》發(fā)表研究,揭示TCF25蛋白在葡萄糖饑餓條件下調(diào)控代謝應(yīng)激與細(xì)胞死亡的關(guān)鍵功能。研究發(fā)現(xiàn),TCF25在葡萄糖饑餓時發(fā)生溶酶體轉(zhuǎn)位,與ATP6V1A相互作用,促進(jìn)溶酶體酸化,增強其降解能力以維持細(xì)胞短期存活。然而,長期葡萄糖饑餓通過TCF25介導(dǎo)的溶酶體過度活化,引發(fā)鐵自噬和溶酶體膜破裂,導(dǎo)致溶酶體依賴性細(xì)胞死亡(LCD)。在小鼠肝缺血再灌注模型中,TCF25敲除顯著減輕組織損傷,表明其為缺血性疾病的潛在治療靶點。
09、靶點:TMEM17
應(yīng)用:帕金森病(PD)的治療
來源:Structural insights into the activation of TMEM175 by small molecule.Neuron,2025 Aug 22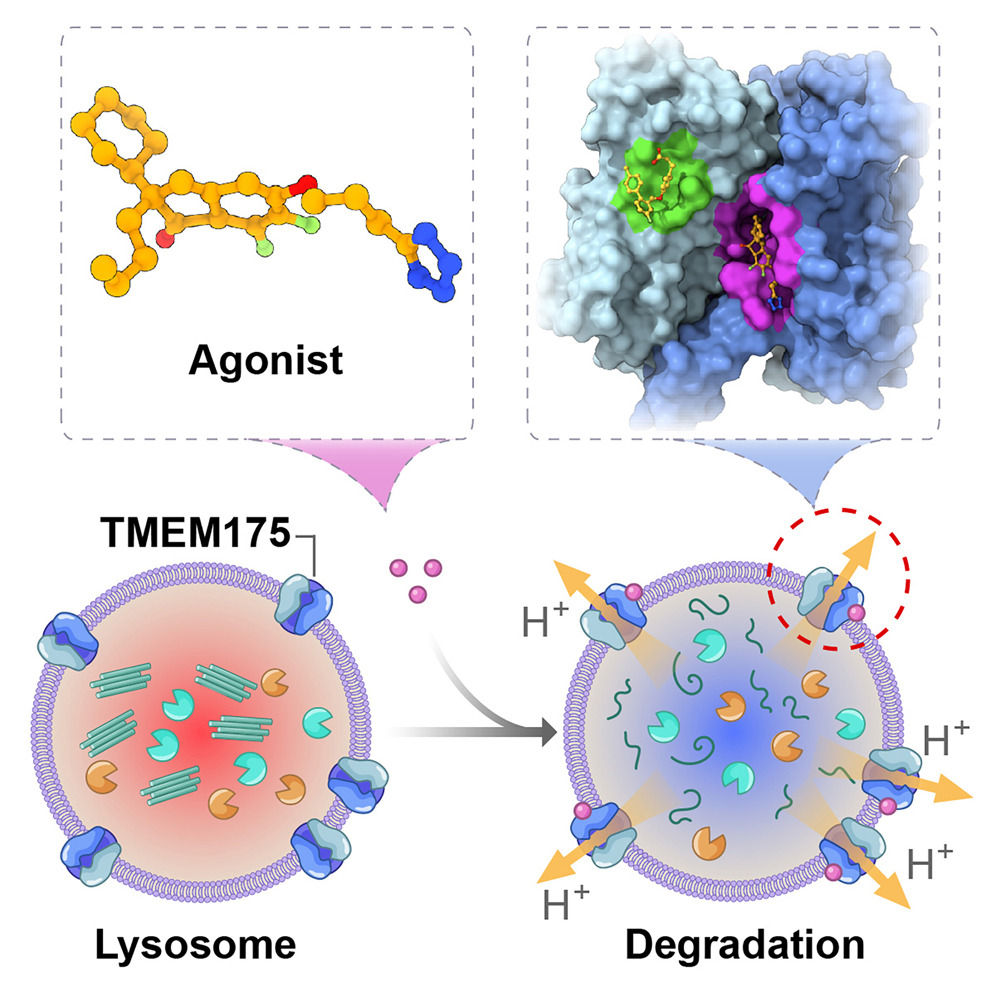
2025年8月26日,中科中山藥物創(chuàng)新研究院李平研究員團(tuán)隊在《Neuron》發(fā)表研究,開發(fā)出多個溶酶體TMEM175氫離子通道的高效激活劑,并解析了其與TMEM175的復(fù)合物冷凍電鏡結(jié)構(gòu),揭示了小分子動態(tài)調(diào)控TMEM175的分子機制。研究發(fā)現(xiàn),這些激活劑能顯著促進(jìn)細(xì)胞對α-突觸核蛋白聚集體的清除,改善帕金森病(PD)模型的病理癥狀,為PD的個性化治療提供了新策略。
10、靶點:NAT10
應(yīng)用:減輕肝臟衰老及肝纖維化表型
來源:Aging increases susceptibility to liver fibrosis through enhanced NAT10-mediated ac4C modification of TGFβ1 mRNA.Genome Med,2025 Aug 15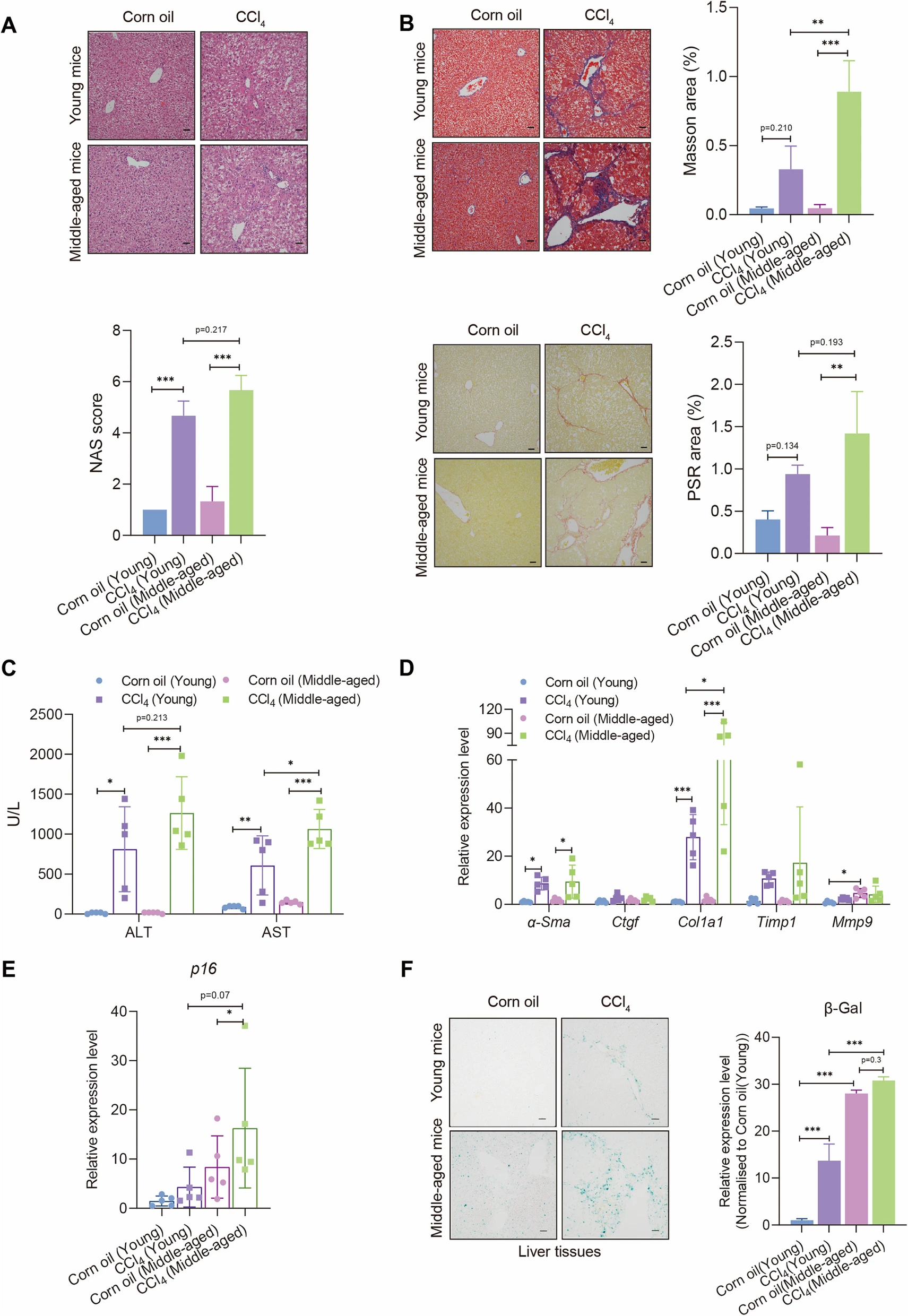
2025年9月1日,中山大學(xué)附屬第三醫(yī)院張琪/梁偉鋮團(tuán)隊在《Genome Medicine》發(fā)表研究,揭示衰老通過RNA乙酰轉(zhuǎn)移酶NAT10增強肝纖維化易感性的新機制。研究發(fā)現(xiàn),衰老細(xì)胞分泌的TGFβ1靶向SMAD2/3,增強NAT10的mRNA轉(zhuǎn)錄。NAT10誘導(dǎo)TGFβ1 mRNA發(fā)生ac4C乙酰化修飾,被RNA結(jié)合蛋白PTBP1識別后提高其穩(wěn)定性,促進(jìn)TGFβ1介導(dǎo)的肝星狀細(xì)胞活化及肝纖維化。在四氯化碳誘導(dǎo)的肝纖維化模型中,中年小鼠比年輕小鼠更易受影響,NAT10在衰老及肝纖維化樣本中顯著上調(diào)。使用NAT10抑制劑Remodelin可減輕肝臟衰老及肝纖維化表型。
推薦產(chǎn)品
參考文獻(xiàn)
[1] SLC45A4 is a pain gene encoding a neuronal polyamine transporter.Nature,2025 Aug 20
應(yīng)用:靶向SLC45A4的鎮(zhèn)痛療法
來源:SLC45A4 is a pain gene encoding a neuronal polyamine transporter.Nature,2025 Aug 20

圖源:10.1038/s41586-025-09326-y[1]
2025年8月20日,由牛津大學(xué)David L. Bennett和Simon Newstead教授共同領(lǐng)導(dǎo)的團(tuán)隊在《Nature》發(fā)表研究論文,揭示神經(jīng)元特異性多胺轉(zhuǎn)運蛋白SLC45A4作為重要疼痛基因的關(guān)鍵作用。通過英國生物樣本庫(UK Biobank)的全基因組關(guān)聯(lián)分析(GWAS),研究首次發(fā)現(xiàn)SLC45A4基因座變異與人類慢性疼痛強度顯著相關(guān)。機制研究表明,SLC45A4在背根神經(jīng)節(jié)感覺神經(jīng)元(包括傷害性感受器)中高度表達(dá),其冷凍電鏡結(jié)構(gòu)揭示了一個獨特的調(diào)控結(jié)構(gòu)域和多胺識別位點。功能實驗證實SLC45A4是選擇性質(zhì)膜多胺轉(zhuǎn)運體,調(diào)控多胺穩(wěn)態(tài)。基因敲除小鼠表現(xiàn)為傷害性熱敏感性和化學(xué)致痛反應(yīng)降低,與C多模式傷害性感受器興奮性下降相關(guān)。該研究不僅揭示了多胺轉(zhuǎn)運在疼痛感知中的新機制,還為開發(fā)靶向SLC45A4的鎮(zhèn)痛療法提供了重要理論依據(jù)和轉(zhuǎn)化前景。
02、靶點:RBPMS、RBPMS2
應(yīng)用:心肌病與先天性心臟病的治療
來源:RBPMS and RBPMS2 Cooperate to Safeguard Cardiac Splicing.Circ Res,2025 Sep 12

圖源:10.1161/CIRCRESAHA.125.326948[2]
2025年8月27日,美國梅森醫(yī)學(xué)研究所吳同彬團(tuán)隊和加州大學(xué)圣地亞哥分校陳炬團(tuán)隊合作于《Circulation Research》在線發(fā)表研究論文。研究揭示了RBPMS與RBPMS2兩種心臟剪接因子在維持心臟特有剪接模式和肌小節(jié)結(jié)構(gòu)中的協(xié)作機制。利用CRISPR-Cas9技術(shù)構(gòu)建小鼠模型,發(fā)現(xiàn)單敲除RBPMS會導(dǎo)致左心室壁致密化不足及輕度心功能異常,雙敲除則會導(dǎo)致胚胎早期死亡和嚴(yán)重的心臟結(jié)構(gòu)缺陷。RNA測序分析顯示,兩種蛋白協(xié)同調(diào)控關(guān)鍵外顯子的剪接,共同維持心臟特有的剪接特征。研究為理解心肌病與先天性心臟病的分子基礎(chǔ)提供了新視角,并為未來分子干預(yù)治療心臟疾病提供了關(guān)鍵突破口。
03、靶點:SLC38A2
應(yīng)用:開發(fā)新型降壓藥物
來源:Inhibiting SLC38A2 lowers blood pressure in rodent models of hypertension.Sci Transl Med,2025 Sep 03

圖源:10.1126/scitranslmed.adt5947[3]
2025年9月3日,華東師范大學(xué)張曉燕教授團(tuán)隊聯(lián)合大連醫(yī)科大學(xué)管又飛教授和華中科技大學(xué)同濟醫(yī)院汪道文教授團(tuán)隊,在《Science Translational Medicine》發(fā)表研究論文,揭示血管內(nèi)皮氨基酸轉(zhuǎn)運體SLC38A2在血壓調(diào)控中的關(guān)鍵作用。研究發(fā)現(xiàn),SLC38A2在高鹽飲食誘導(dǎo)的高血壓大鼠主動脈內(nèi)皮細(xì)胞中顯著上調(diào)。內(nèi)皮細(xì)胞特異性敲除Slc38a2的小鼠基礎(chǔ)血壓顯著降低,且對高鹽飲食及DOCA鹽誘導(dǎo)的高血壓有抵抗能力。機制上,SLC38A2缺失導(dǎo)致細(xì)胞內(nèi)谷氨酰胺水平降低,激活A(yù)KT-eNOS信號通路,增加NO生成,促進(jìn)血管舒張。此外,SLC38A2的小分子抑制劑MeAIB在動物模型中也展現(xiàn)出顯著的降壓效果。該研究為開發(fā)新型降壓藥物提供了全新靶點。
04、靶點:FOXQ1
應(yīng)用:相關(guān)神經(jīng)疾病研究
來源:FOXQ1 Regulates Brain Endothelial Mitochondrial Function by Orchestrating Calcium Signaling and Cristae Morphology.Adv Sci (Weinh),
2025 Aug 30

圖源:10.1002/advs.202503082[4]
2025年8月30日,廣東醫(yī)科大學(xué)附屬醫(yī)院張晶晶團(tuán)隊與中國科學(xué)院動物研究所焦建偉團(tuán)隊合作在《Advanced Science》發(fā)表論文,揭示轉(zhuǎn)錄因子FOXQ1是調(diào)控腦內(nèi)皮細(xì)胞線粒體功能的關(guān)鍵因子。研究發(fā)現(xiàn),腦內(nèi)皮細(xì)胞不僅依賴糖酵解供能,更需要高效的氧化磷酸化滿足大腦高能量需求。FOXQ1缺失會導(dǎo)致腦內(nèi)皮細(xì)胞線粒體結(jié)構(gòu)異常、功能崩潰,細(xì)胞啟動代謝應(yīng)急,但仍無法滿足能量需求。該研究顛覆了內(nèi)皮細(xì)胞代謝的傳統(tǒng)認(rèn)知,為理解神經(jīng)疾病中的腦血管功能異常提供了新視角。
05、靶點:ACACA、LSS
應(yīng)用:胃癌治療
來源:A combined enteric neuron-gastric tumor organoid reveals metabolic vulnerabilities in gastric cancer.Cell Stem Cell,2025 Oct 02

圖源:10.1016/j.stem.2025.08.006[5]
2025年9月2日,香港大學(xué)李嘉誠醫(yī)學(xué)院黃兆麟團(tuán)隊在《Cell Stem Cell》發(fā)表研究,揭示胃癌細(xì)胞與腸神經(jīng)元之間的動態(tài)互動及其代謝調(diào)控機制。研究開發(fā)了腸神經(jīng)元-胃癌類器官共同培養(yǎng)模型,通過CRISPR-Cas9高通量基因篩選,發(fā)現(xiàn)ACACA和LSS兩個關(guān)鍵脂質(zhì)代謝因子對癌細(xì)胞生存至關(guān)重要。小鼠實驗顯示,阻斷這些因子可減緩腫瘤生長。研究還發(fā)現(xiàn),腸神經(jīng)元的存在使胃癌細(xì)胞對脂質(zhì)代謝抑制劑更敏感,為胃癌治療提供了潛在的新靶點和生物標(biāo)記物,有望推動個性化治療的發(fā)展。
06、靶點:ZBP1
應(yīng)用:阿爾茨海默病(AD)治療
來源:Innate immune sensing of Z-nucleic acids by ZBP1-RIPK1 axis drives neuroinflammation in Alzheimer's disease.Immunity,2025 Aug 25

圖源:10.1016/j.immuni.2025.07.024[6]
2025年9月2日,中科院上海有機化學(xué)研究所許代超團(tuán)隊在《Immunity》發(fā)表研究,揭示氧化型Z型線粒體DNA(Z-mtDNA)作為ZBP1的新型內(nèi)源性配體,可驅(qū)動小膠質(zhì)細(xì)胞介導(dǎo)的神經(jīng)炎癥。在阿爾茨海默病(AD)病理環(huán)境下,氧化應(yīng)激導(dǎo)致mtDNA斷裂并形成Z-DNA,被ZBP1識別后激活RIPK1,促進(jìn)多條促炎通路,導(dǎo)致神經(jīng)炎癥和AD病理變化。在AD模型中,敲除ZBP1或抑制RIPK1活性可顯著緩解神經(jīng)炎癥和病理缺陷。這一發(fā)現(xiàn)為AD神經(jīng)免疫調(diào)控機制提供了新視角,為治療AD提供了潛在靶點。
07、靶點:IP6K2
應(yīng)用:炎癥性腸癌的治療
來源:Hongyun Zhang et al. Oncometabolite 5-IP7 inhibits inositol 5-phosphatase to license E-cadherin endocytosis.Nat Chem Biol,2025 Aug 26

圖源:10.1038/s41589-025-02005-z[7]
2025年9月2日,南方科技大學(xué)饒楓團(tuán)隊在《Nature Chemical Biology》發(fā)表研究,揭示IP6K2及其產(chǎn)物5-IP7在炎癥性結(jié)直腸癌中的作用機制。研究發(fā)現(xiàn),IP6K2在結(jié)直腸癌組織中高表達(dá),與患者生存率負(fù)相關(guān)。5-IP7通過抑制5-磷酸酶OCRL活性,導(dǎo)致PI(4,5)P2累積,促進(jìn)E-鈣黏蛋白內(nèi)吞,破壞腸上皮屏障,激活β-連環(huán)蛋白致癌通路。團(tuán)隊還篩選出IP6K2抑制劑異鼠李素,可顯著降低結(jié)腸癌腫瘤數(shù)量和體積,為炎癥性腸癌的治療提供了新靶點和潛在藥物。
08、靶點:TCF25
應(yīng)用:缺血性疾病的潛在治療靶點
來源:TCF25 serves as a nutrient sensor to orchestrate metabolic adaptation and cell death by enhancing lysosomal acidification under glucose starvation.Cell Rep,2025 Sep 23

圖源:10.1016/j.celrep.2025.116186[8]
2025年9月2日,同濟大學(xué)蔡振宇課題組在《Cell Reports》發(fā)表研究,揭示TCF25蛋白在葡萄糖饑餓條件下調(diào)控代謝應(yīng)激與細(xì)胞死亡的關(guān)鍵功能。研究發(fā)現(xiàn),TCF25在葡萄糖饑餓時發(fā)生溶酶體轉(zhuǎn)位,與ATP6V1A相互作用,促進(jìn)溶酶體酸化,增強其降解能力以維持細(xì)胞短期存活。然而,長期葡萄糖饑餓通過TCF25介導(dǎo)的溶酶體過度活化,引發(fā)鐵自噬和溶酶體膜破裂,導(dǎo)致溶酶體依賴性細(xì)胞死亡(LCD)。在小鼠肝缺血再灌注模型中,TCF25敲除顯著減輕組織損傷,表明其為缺血性疾病的潛在治療靶點。
09、靶點:TMEM17
應(yīng)用:帕金森病(PD)的治療
來源:Structural insights into the activation of TMEM175 by small molecule.Neuron,2025 Aug 22

圖源:10.1016/j.neuron.2025.07.029[9]
2025年8月26日,中科中山藥物創(chuàng)新研究院李平研究員團(tuán)隊在《Neuron》發(fā)表研究,開發(fā)出多個溶酶體TMEM175氫離子通道的高效激活劑,并解析了其與TMEM175的復(fù)合物冷凍電鏡結(jié)構(gòu),揭示了小分子動態(tài)調(diào)控TMEM175的分子機制。研究發(fā)現(xiàn),這些激活劑能顯著促進(jìn)細(xì)胞對α-突觸核蛋白聚集體的清除,改善帕金森病(PD)模型的病理癥狀,為PD的個性化治療提供了新策略。
10、靶點:NAT10
應(yīng)用:減輕肝臟衰老及肝纖維化表型
來源:Aging increases susceptibility to liver fibrosis through enhanced NAT10-mediated ac4C modification of TGFβ1 mRNA.Genome Med,2025 Aug 15

圖源:10.1186/s13073-025-01520-x[10]
2025年9月1日,中山大學(xué)附屬第三醫(yī)院張琪/梁偉鋮團(tuán)隊在《Genome Medicine》發(fā)表研究,揭示衰老通過RNA乙酰轉(zhuǎn)移酶NAT10增強肝纖維化易感性的新機制。研究發(fā)現(xiàn),衰老細(xì)胞分泌的TGFβ1靶向SMAD2/3,增強NAT10的mRNA轉(zhuǎn)錄。NAT10誘導(dǎo)TGFβ1 mRNA發(fā)生ac4C乙酰化修飾,被RNA結(jié)合蛋白PTBP1識別后提高其穩(wěn)定性,促進(jìn)TGFβ1介導(dǎo)的肝星狀細(xì)胞活化及肝纖維化。在四氯化碳誘導(dǎo)的肝纖維化模型中,中年小鼠比年輕小鼠更易受影響,NAT10在衰老及肝纖維化樣本中顯著上調(diào)。使用NAT10抑制劑Remodelin可減輕肝臟衰老及肝纖維化表型。
推薦產(chǎn)品
參考文獻(xiàn)
[1] SLC45A4 is a pain gene encoding a neuronal polyamine transporter.Nature,2025 Aug 20
[2]RBPMS and RBPMS2 Cooperate to Safeguard Cardiac Splicing.Circ Res,2025 Sep 12
[3]Inhibiting SLC38A2 lowers blood pressure in rodent models of hypertension.Sci Transl Med,2025 Sep 03
[4]FOXQ1 Regulates Brain Endothelial Mitochondrial Function by Orchestrating Calcium Signaling and Cristae Morphology.Adv Sci (Weinh),2025 Aug 30
[5]A combined enteric neuron-gastric tumor organoid reveals metabolic vulnerabilities in gastric cancer.Cell Stem Cell,2025 Oct 02
[6]Innate immune sensing of Z-nucleic acids by ZBP1-RIPK1 axis drives neuroinflammation in Alzheimer's disease.Immunity,2025 Aug 25
[7]Hongyun Zhang et al. Oncometabolite 5-IP7 inhibits inositol 5-phosphatase to license E-cadherin endocytosis.Nat Chem Biol,2025 Aug 26
[8]TCF25 serves as a nutrient sensor to orchestrate metabolic adaptation and cell death by enhancing lysosomal acidification under glucose starvation.Cell Rep,2025 Sep 23
[9]Structural insights into the activation of TMEM175 by small molecule.Neuron,2025 Aug 22
[10]Aging increases susceptibility to liver fibrosis through enhanced NAT10-mediated ac4C modification of TGFβ1 mRNA.Genome Med,2025 Aug 15
*免責(zé)聲明:華美生物內(nèi)容團(tuán)隊僅是分享和解讀公開研究論文及其發(fā)現(xiàn),本文僅作信息交流,文中觀點不代表華美生物立場,請理解。












