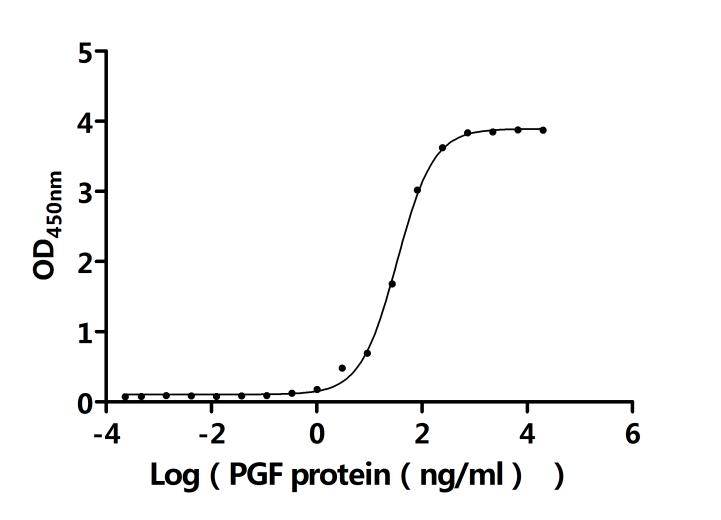
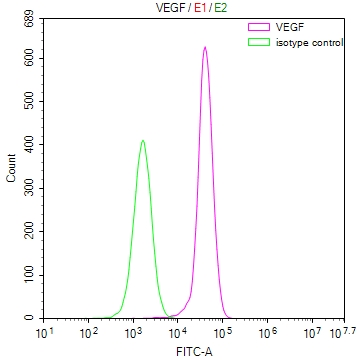
FLT1(VEGFR-1):血管生成的雙向調節器與疾病治療新靶點
日期:2025-10-20 13:24:58
血管內皮生長因子受體(VEGFR)家族一直是熱門靶點,其中,FLT1(VEGFR-1)以其獨特的“雙向調控”角色脫穎而出。FTL1遠非一個簡單的信號接收器,它既能通過膜結合形式傳遞信號,促進內皮細胞遷移與血管重塑;也能通過其可溶性形式sFLT1“捕獲”配體,負反饋抑制血管過度增生,從而在促血管生成與抗血管生成之間維持著至關重要的動態平衡。
近年研究表明,這一平衡的打破直接參與肝纖維化、肺損傷修復障礙、骨關節炎乃至腫瘤進展等多種病理過程。隨著其在免疫調節與藥物耐藥中的新角色被不斷揭示,FLT1已成為一個極具潛力的疾病治療新靶點,吸引著從基礎科研到藥物研發的廣泛關注。本文將系統梳理FLT1的生物學功能、信號網絡及其在相關疾病中的最新研究進展。
1. FLT1的背景介紹
1.1 生物學特性與功能
FLT1(VEGFR-1)是血管內皮生長因子受體(VEGFR)家族成員,屬于典型Ⅲ型受體酪氨酸激酶。其結構包括7個胞外免疫球蛋白樣結構域、單次跨膜區及胞內酪氨酸激酶結構域 [1]。通過可選擇性剪接產生的可溶性FLT1(sFLT1)缺乏跨膜及激酶結構域,但保留VEGF結合能力,是內源性VEGF信號拮抗劑 [2]。晶體結構顯示,FLT1與VEGF-A形成1:2復合物,其中第二免疫球蛋白樣結構域(D2)決定配體識別,而D3參與受體二聚化激活 [3]。FLT1對VEGF家族配體呈差異親和力,對VEGF-B和胎盤生長因子(PlGF)的結合高于VEGFR-2。
在血管生成過程中,FLT1通過雙重機制發揮調控作用:膜結合型FLT1激活后招募Gab1,進而激活PI3K-Akt-mTOR通路,促進內皮細胞遷移 [4];而sFLT1通過中和游離VEGF抑制血管過度增生,維持血管穩態 [1]。研究表明,FLT1敲除小鼠因血管發育異常導致胚胎致死,其表型與VEGFR-2缺陷明顯不同 [2]。FLT1激酶結構域第1210位酪氨酸磷酸化可特異性激活HIF-1α-VEGF正反饋環路,在低氧環境下放大促血管生成信號 [4]。此外,FLT1通過非經典途徑調控Rho GTPases活性,影響內皮骨架重組與管腔形成 [3]。
FLT1的功能依賴動態糖基化修飾。N-連接糖基化影響受體膜定位,并通過調節配體結合親和力控制信號強度。病理條件下,金屬蛋白酶ADAM17介導的FLT1胞外域脫落產生sFLT1片段,該過程受TNF-α和氧化應激顯著誘導 [1]。FLT1在特定組織中表現出血管生成非依賴性功能,如在神經元中激活TrkB通路調節突觸可塑性,在軟骨細胞中抑制MMP-13表達延緩基質降解 [3][4]。這一多功能性使FLT1成為血管系統與微環境的重要連接節點。
1.2 在VEGF家族中的定位
血管內皮生長因子(VEGF)家族包括VEGF-A、VEGF-B、VEGF-C、VEGF-D及胎盤生長因子(PlGF),其受體為FLT1(VEGFR-1)、KDR(VEGFR-2)及FLT4(VEGFR-3)[5]。FLT1是首個鑒定的VEGF受體,對VEGF-B和PlGF結合特異性高于VEGFR-2,但激酶活性較弱,主要發揮調控作用 [1]。
FLT1與VEGFR-2互補調控血管生成:VEGFR-2介導內皮增殖、遷移和通透性增加,而FLT1通過競爭性結合VEGF-A抑制VEGFR-2過度激活,或激活PLCγ-PKC-MAPK通路維持血管穩態 [5]。FLT1基因敲除小鼠因血管過度增生致死,而僅保留胞外段的截短型FLT1轉基因小鼠可正常存活,表明其負調控作用主要依賴配體捕獲機制 [3]。PlGF-FLT1軸可在病理條件下激活PI3K/Akt通路,促進血管重塑,在缺血性疾病和腫瘤血管生成中發揮關鍵作用 [6]。
FLT1與VEGFR-3協同調控血管-淋巴管平衡。VEGFR-3響應VEGF-C/D促進淋巴管生成,而FLT1通過形成異源二聚體增強淋巴管內皮對低濃度VEGF-C的敏感性 [1]。在傷口修復模型中,FLT1缺陷可導致淋巴管密度降低約40% [3]。sFLT1作為天然拮抗劑,通過結合循環VEGF-A和PlGF調控血管通透性,其水平異常升高與子癇前期發病相關 [5]。蛋白組學顯示,sFLT1對VEGF-A165親和力是VEGFR-2的5倍,但對VEGF-A121抑制作用有限,這種亞型選擇性為血管疾病治療提供靶向策略 [2]。
1.3 FLT1表達調控機制
FLT1表達受多層級調控:
- 低氧:α結合FLT1啟動子缺氧反應元件,上調轉錄 [7]
- 氧化應激:ROS激活NF-κB,穩定FLT1 mRNA,提高蛋白水平2-3倍 [8]
- 表觀遺傳:5-氮雜胞苷降低啟動子CpG島甲基化,骨髓基質細胞中表達量提升40%
- miRNA調控:miR-206抑制FLT1翻譯,miR-210低氧條件下下調,間接增強表達 [3]
- 炎癥因子:TNF-α通過p38 MAPK/NF-κB/AP-1在6小時內誘導表達峰值 [7]
- 機械應力:流體剪切力通過Piezo1觸發鈣信號,使動脈內皮FLT1表達空間異質性,高剪切力區域表達降低約35% [8]
- 激素調控:糖皮質激素受體與啟動子結合抑制轉錄,Notch信號Hes1競爭結合增強子區域抑制表達 [3][4]
2. FLT1的研究機制
2.1 經典信號通路
FLT1結合VEGF誘導二聚化,自磷酸化后招募Akt等銜接蛋白,形成信號復合物 [4]。
- Akt通路:抑制GSK-3β并激活mTORC1,促進內皮存活和遷移,同時上調HIF-1α穩定性 [8]
- HIF-1α正反饋:低氧下增強VEGF轉錄,放大血管生成信號 [9]
- PLCγ-PKC-MAPK:調控血管穩態和遷移
VEGF刺激呈時空特異性,短期增強血管通透性,長期促進血管新生 [5]。FLT1與VEGFR-2形成異源二聚體協同調控PI3K-Akt和ERK1/2分支,Akt磷酸化水平與微血管密度正相關。TNF-α可通過NF-κB抑制HIF-1α,阻斷FLT1-VEGF正反饋循環,導致血管生成障礙 [8]。
2.2 與其他受體協同作用
FLT1與VEGFR-2形成復合物,FLT1偏向PLCγ-PKC-MAPK通路,VEGFR-2偏向PI3K-Akt通路 [4]。低氧下,FLT1競爭性結合VEGF-B/PlGF,減少VEGFR-2過度激活,維持血管穩態 [5]。受體比例和磷酸化狀態動態平衡信號輸出,sFLT1水平變化進一步精細調控血管生成 [2][5]。在軟骨修復中,FLT1/VEGFR-2比例變化影響血管侵襲和MMP-9分泌,為組織工程提供有利微環境 [5]。
2.3 信號網絡調控模式
- 正反饋:α/FLT1增強VEGF表達 [9]
- 負反饋:sFLT1中和VEGF、PTP1B去磷酸化、c-Cbl介導降解 [10][11]
- 動態平衡失衡:過度激活導致腫瘤血管增生,過度抑制阻礙組織修復 [4]
網絡藥理學研究顯示,天然產物和復方藥物可通過調節FLT1及其下游信號實現血管穩態平衡 [11]。
3. FLT1相關疾病研究
3.1 肝纖維化
FLT1介導血管生成在肝纖維化中促進病理血管形成和細胞外基質沉積 [9]。四氯化碳誘導小鼠模型中,FLT1表達與纖維化程度正相關,抑制FLT1可降低膠原沉積和肝星狀細胞活化。PDGF/VEGF自分泌環加速肌成纖維細胞轉化,雙靶點抑制劑RC28-E可減少膠原沉積,顯示潛在治療價值 [12]。單細胞測序顯示,纖維化肝臟中FLT1+內皮亞群與炎癥因子IL-6、TGF-β1表達高度重疊 [13]。脂毒性環境通過sFLT1上調導致血管功能障礙 [14]。
3.2 肺損傷修復
FLT1在肺損傷修復中表現雙重作用:急性期維持血管完整性,慢性期過度激活導致血管異常。博來霉素誘導模型顯示,FLT1上調VEGF-A促病理性毛細血管增生,RC28-E抑制TGF-β1/Smad3改善肺功能 [12]。MSC-EVs攜帶miR-214-3p抑制FLT1翻譯,促進肺泡上皮再生 [15][16]。FLT1抑制劑在損傷后7-14天干預效果最佳,可平衡促血管生成與抗纖維化需求。
3.3 軟骨損傷修復
FLT1調控軟骨下血管形成,通過HIF-1α信號促進內皮遷移和新生血管形成 [3]。適度血管化利于干細胞遷移和營養供應,sFLT1通過競爭VEGF抑制過度血管化,維持軟骨-骨界面穩態 [15]。FLT1抑制可減少MMP-2/9釋放,降低基質降解風險 [10],結合抗FLT1抗體水凝膠支架可實現軟骨結構性修復 [15]。
4. FLT1靶向藥物研發
近年來,針對FLT1的靶向藥物研發取得了顯著進展,尤其在抗腫瘤免疫和耐藥逆轉方面展現出潛力。例如,研究發現FLT1的激活可通過非經典途徑保護癌細胞免受PARP抑制劑(PARPi)的抑制。通過使用FLT1抑制劑(如阿昔替尼)或基因敲除,能夠抑制AKT信號通路,增加CD8+ T細胞浸潤,顯著逆轉PARPi耐藥性。目前有10款小分子藥物已批準上市,其余部分在研管線如下表:
| 藥物 | 作用機制 | 藥物類型 | 在研適應癥 | 在研機構 | 最高研發階段 |
|---|---|---|---|---|---|
| 德立替尼 | FGFR1拮抗劑 | FGFR2拮抗劑 | VEGFR1拮抗劑 | VEGFR2拮抗劑 | VEGFR3拮抗劑 | 小分子化藥 | 結腸癌 | 鼻咽腫瘤 | 南京愛德程醫藥科技有限公司 | 上海海和藥物研究開發股份有限公司 | 臨床3期 |
| 西地尼布 | PDGFRβ抑制劑 | VEGFR1拮抗劑 | VEGFR2拮抗劑 | VEGFR3拮抗劑 | c-Kit抑制劑 | 小分子化藥 | 卵巢子宮內膜樣癌 | 輸卵管透明細胞腺癌 | 卵巢透明細胞腺癌 | 卵巢混合上皮癌等 | National Cancer Institute | AstraZeneca PLC | The University of Texas MD Anderson Cancer Center | 臨床3期 |
| Zanzalintinib | AXL抑制劑 | MerTK抑制劑 | VEGFR1拮抗劑 | c-Met抑制劑 | 小分子化藥 | 轉移性透明細胞性腎細胞癌 | 腎細胞癌 | 轉移性結直腸癌 | 胰腺外神經內分泌腫瘤等 | Exelixis, Inc. | 臨床3期 |
| 司曲替尼 | AXL抑制劑 | RET抑制劑 | Tie-2拮抗劑 | VEGFR1拮抗劑 | VEGFR2拮抗劑 | VEGFR3拮抗劑 | c-Met抑制劑 | 小分子化藥 | 腫瘤 | 晚期鱗狀非小細胞肺癌 | 轉移性非鱗狀非小細胞肺癌 | 肝轉移等 | BeOne Medicines Ltd. | Mirati Therapeutics, Inc. | 百濟神州(廣州)醫藥有限公司 | 臨床3期 |
| VEGFR-1/2 peptide vaccine(Keio University) | VEGFR1拮抗劑 | VEGFR2拮抗劑 | 通用抗原疫苗 | 合成肽疫苗 | 治療性疫苗 | 膠質瘤 | 神經纖維瘤病 | Keio University | 臨床2期 |
| YP-01001 | FGFRs拮抗劑 | RET抑制劑 | VEGFR1拮抗劑 | VEGFR2拮抗劑 | VEGFR3拮抗劑 | 小分子化藥 | 實體瘤 | 晚期惡性實體瘤 | 甲狀腺癌 | 重慶藥友制藥有限責任公司 | 上海復星醫藥(集團)股份有限公司 | 臨床2期 |
| CBP-4888 | VEGFR1拮抗劑 | siRNA | 先兆子癇 | Comanche Biopharma Corp. | 臨床1期 |
| Dual-targeting VEGFR1 and PD-L1 CAR-T cells(Sichuan University) | PDL1調節劑 | VEGFR1調節劑 | T淋巴細胞替代物 | CAR-T | - | 四川大學 | 臨床1期 |
| 羥氯喹/索拉非尼 | BRAF抑制劑 | CRAF抑制劑 | FLT3抑制劑 | PDGFRβ抑制劑 | RET抑制劑 | VEGFR1拮抗劑 | VEGFR2拮抗劑 | VEGFR3拮抗劑 | c-Kit抑制劑 | 小分子化藥 | 卵巢癌 | VG Life Sciences, Inc. | 臨床1期 |
5. 華美生物FLT1研究相關產品
FLT1作為血管生成和免疫調控的重要因子,已成為多種疾病的研究焦點。其在CMS、PAH、OA及腫瘤等疾病中的異常表達,提示其不僅是潛在的診斷標志物,也是治療干預的重要靶點。
華美生物已開發出多種FLT1相關研究產品,包括重組蛋白、抗體和ELISA世界和,助您進行FLT1相關機制研究和藥物開發。
參考文獻:
[1] Yan‐Xia Zhang, Mi‐Rong Jing, Chunbo Cai, Shuai‐Gang Zhu, C. Zhang, Qi‐Meng Wang, Yuankun Zhai, Xin‐Ying Ji, Dongdong Wu. Role of hydrogen sulphide in physiological and pathological angiogenesis[J]. Cell Proliferation, 2022, 56(3).
[2] Fan-Wei Peng, Dake Liu, Qingwen Zhang, Yungen Xu, Lei Shi. VEGFR-2 inhibitors and the therapeutic applications thereof: a patent review (2012-2016)[J]. Expert Opinion on Therapeutic Patents, 2017, 27(9): 987-1004.
[3] Leopold F. Fr?hlich. MicroRNAs at the Interface between Osteogenesis and Angiogenesis as Targets for Bone Regeneration[J]. Cells, 2019, 8(2): 121-121.
[4] Alexander Panossian, Ean‐Jeong Seo, Thomas Efferth. Novel molecular mechanisms for the adaptogenic effects of herbal extracts on isolated brain cells using systems biology[J]. Phytomedicine, 2018, 50: 257-284.
[5] Samanta Taurone, Filippo Galli, Alberto Signore, Enzo Agostinelli, Rudi Dierckx, Antonio Minni, Marcella Pucci, Marco Artico. VEGF in nuclear medicine: Clinical application in cancer and future perspectives (Review)[J]. International Journal of Oncology, 2016, 49(2): 437-447.
[6] Peiyu Liu, Dandan Sun, Shuchang Zhang, Shimei Chen, Xiaoqian Wang, Huiming Li, Wei Fang. PFKFB3 in neovascular eye disease: unraveling mechanisms and exploring therapeutic strategies[J]. Cell & Bioscience, 2024, 14(1).
[7] Maria Giovanna Scioli, Gabriele Storti, Federico D’Amico, Roger Rodríguez Guzmán, Federica Centofanti, Elena Doldo, Ela María Céspedes Miranda, Augusto Orlandi. Oxidative Stress and New Pathogenetic Mechanisms in Endothelial Dysfunction: Potential Diagnostic Biomarkers and Therapeutic Targets[J]. Journal of Clinical Medicine, 2020, 9(6): 1995-1995.
[8] Fengyan Jin, Xiangyu Zheng, Yanping Yang, Gang Yao, Long Ye, Thorsten R. Doeppner, Dirk M. Hermann, Haifeng Wang, Yun Dai. Impairment of hypoxia-induced angiogenesis by LDL involves a HIF-centered signaling network linking inflammatory TNFα and angiogenic VEGF[J]. Aging, 2019, 11(2): 328-349.
[9] Huajuan Jiang, Xulong Huang, Jiaxin Wang, Yongfeng Zhou, Chaoxiang Ren, Tao Zhou, Jin Pei. Hepatoprotective Effect of Medicine Food Homology Flower Saffron against CCl4-Induced Liver Fibrosis in Mice via the Akt/HIF-1α/VEGF Signaling Pathway[J]. Molecules, 2023, 28(21): 7238-7238.
[10] Weiwei Wu, Jiaying Zhao, Yingying Li, Wendi Sun, Xiaohong Ye, Xinyan Chang, Yao He, Qing Jin. Rg1 inhibits the VEGF-Flt1 signaling pathway and microvascular remodeling in knee osteoarthritis rats[J]. Phytotherapy Research, 2022, 36(11): 4991-5002.
[11] Limin Wang, Wenxia Zhang, Bing Zhao, Huijuan Li, Qing Liu, Ping Xu, Jianyong Lei, Zhibin Wang, Xinfeng Yan, Conghui Li. The effect of combined treatment with Salvia miltiorrhiza and Panax notoginseng on vascular regeneration and tissue repair of osteoarthritis[J]. Biomedicine & Pharmacotherapy, 2023, 164: 114869-114869.
[12] Siyuan Chen, Qiang Fu, Yinyan Tang, Ping Wang, Yali Zheng, Ling Ye, Feng Xu. Bispecific antibodies targeting VEGF/Ang-2 for the treatment of liver fibrosis[J]. Immunologic Research, 2023, 71(5): 682-693.
[13] Yuan Xu, Chen Wei, Shuang Liu, Han Sun, Chen Chen, Mengru Li, Zhuohang Li, Wenxing Hu, Xiaobing Wang, Xianmei Meng, Li Li, Hongbo Xin. Single-cell RNA sequencing uncovers heterogeneity and crosstalk of hepatic stellate cells in a CCl4-induced liver fibrosis model[J]. Hepatology Communications, 2024, 8(4): 281-297.
[14] Samantha Lai, Simona Grassi, Vincenzo Nicola Talesa, Francesca Margheri, Lucia Magnelli. Endothelial Dysfunction in Chronic Kidney Disease: Highlighting the Role of FGF23 and Klotho[J]. International Journal of Molecular Sciences, 2024, 25(9): 5689-5689.
[15] Zhen Chen, Yingjie He, Yuchen Wu, Hui Chen, Xiaoyang Hou, Xiang Xiao, Yang Zhang, Jun Zou, Lei Pei, Jing Su, Chunlin Zhang, Xingdong Zhang, Yunsong Liu. Extracellular vesicles from mesenchymal stem cells promote chondrocyte proliferation and migration via miR-135b-5p-mediated modulation of FGF18 in osteoarthritis[J]. Stem Cell Research & Therapy, 2024, 15(1).
[16] Feng Wu, Yanan Zou, Yabin Xu, Chunjie Jiang, Haijun Bao, Ning Xie, Wenlong He. Bone marrow mesenchymal stem cells derived exosomes regulate VEGF/VEGFR2 signaling to promote lung injury repair[J]. Stem Cell Research & Therapy, 2024, 15(1).