腫瘤干細胞的“命門”:LGR5成80億美元收購焦點
日期:2025-10-20 13:25:56
9月29日,Genmab宣布,公司與Merus達成收購協(xié)議,將以每股97美元的價格收購后者的全部股份,總金額約為80億美元。LGR5/EGFR雙抗Petosemtamab是Genmab此次發(fā)起收購的主要目標,目前正處于3期臨床開發(fā)階段,通過同時靶向EGFR和LGR5,能夠更精準地識別和攻擊腫瘤細胞,展現(xiàn)出顯著的抗腫瘤活性。
此次收購讓LGR5再次進入大眾視野,從腸道再生到結直腸癌治療,LGR5正重塑我們對“干細胞命運”的理解。本文將帶你系統(tǒng)了解這一分子如何連接干細胞與癌癥,揭示其背后的信號通路與藥物研發(fā)新進展。
1. LGR5的分子結構與功能特征
LGR5(Leucine-rich repeat-containing G protein-coupled receptor 5)屬于富含亮氨酸重復序列的G蛋白偶聯(lián)受體(GPCR)家族成員,其典型結構包括七次跨膜結構域和胞外N端富含亮氨酸重復序列(LRR)的結合區(qū) [1]。該結構決定了LGR5兼具配體識別與信號轉導的雙重功能。LRR結構域通常由18–25個重復單元組成,通過β-折疊片層形成穩(wěn)定結構,可與R-spondin(RSPO)家族配體特異性結合;跨膜區(qū)則通過構象變化激活下游G蛋白信號轉導 [2]。

圖1. Schematic presentation of the general structure of GPCRs and LGR5 [1]
研究顯示,LGR5胞內第三環(huán)結構含有多個磷酸化位點,能夠招募β-arrestin介導信號內化,在Wnt/β-catenin等通路中發(fā)揮動態(tài)調控作用 [3]。在信號傳導中,LGR5通過雙重機制增強Wnt信號強度:一方面,LGR5-RSPO復合物與Wnt共受體LRP5/6結合,抑制E3泛素連接酶RNF43/ZNRF3對Wnt受體的內吞降解,從而延長信號激活時間;另一方面,LGR5的Gαs亞基偶聯(lián)可激活cAMP-PKA通路,通過β-catenin的Ser675位點磷酸化增強其轉錄活性 [4]。
單細胞測序結果顯示,LGR5陽性干細胞中Wnt靶基因AXIN2與LEF1表達顯著高于普通細胞,提示其具有信號放大功能 [1]。此外,LGR5胞內C端的PDZ結合基序能與DLG1等支架蛋白形成復合體,進一步調控細胞極性和遷移 [3]。
在組織層面,LGR5呈現(xiàn)明顯的特異性表達模式。在腸道隱窩基底柱狀細胞中,LGR5通過維持Wnt信號梯度調控干細胞的自我更新與分化 [2];在毛囊隆突區(qū),LGR5與BMP信號協(xié)同控制毛囊再生周期 [4]。此外,部分LGR5的剪切變體(如可溶性形式)可競爭性結合配體產生負調控效應,這種異構體在結直腸癌中異常高表達,與腫瘤干性維持密切相關。冷凍電鏡結構解析揭示,LGR5與RSPO2結合界面中Arg72與Glu110等關鍵殘基為設計靶向抑制劑提供了結構基礎 [3]。
2. LGR5在組織發(fā)育與穩(wěn)態(tài)維持中的作用
LGR5的結構特征決定了其在組織發(fā)育與穩(wěn)態(tài)維持中的重要功能。其胞外域含有17個亮氨酸重復序列,可與RSPO家族配體結合并激活下游信號通路。研究發(fā)現(xiàn),LGR5在腸道隱窩基底干細胞中高表達,通過維持Wnt/β-catenin通路活性促進干細胞自我更新和平衡分化,對腸上皮持續(xù)再生具有關鍵作用 [5]。在肝組織中,LGR5陽性細胞在損傷后可快速增殖,促進膽管上皮修復與再生。在皮膚系統(tǒng)中,LGR5在毛囊隆突區(qū)干細胞中周期性表達,維持毛囊再生循環(huán)。
在胚胎發(fā)育過程中,LGR5參與間充質干細胞定向分化,敲除模型顯示其缺失導致長骨生長板結構異常。在成體組織修復中,LGR5陽性細胞表現(xiàn)出遷移和多向分化潛能。例如,在心肌梗死模型中,心外膜LGR5+細胞可轉分化為心肌細胞與血管內皮細胞,促進組織重建。此外,LGR5表達水平與干細胞干性密切相關,其下調會導致干細胞池耗竭并加速組織老化。
在腸道菌群與宿主互作中,LGR5通過調控膽汁酸代謝維持腸屏障功能,表達異常與黏膜通透性增加及炎癥反應增強相關。阻塞性睡眠呼吸暫停患者脂肪組織研究亦表明,LGR5表達變化與脂代謝紊亂存在協(xié)同調控關系,提示其在代謝穩(wěn)態(tài)中具有重要作用 [2]。
3. LGR5介導的Wnt/β-catenin信號通路及交叉調控機制
3.1 Wnt/β-catenin信號通路激活機制
LGR5通過結合R-spondin蛋白家族成員,形成LGR5–RSPO–Wnt受體復合物,從而增強Wnt配體與Frizzled受體結合的穩(wěn)定性,抑制RNF43/ZNRF3介導的Wnt受體降解,延長Wnt/β-catenin信號的活化 [6]。這種調控是細胞命運決定與干性維持的關鍵機制。結構研究表明,LGR5的17個亮氨酸重復單元構成馬蹄形結合域,為RSPO提供高親和力結合位點 [5]。
LGR5介導的Wnt信號調控具有劑量依賴特征。R-spondin的存在可使LGR5介導的信號強度提高十倍以上,而LGR5缺失則導致腸道類器官形成完全受阻 [7]。其胞內第三環(huán)(ICL3)可調控Wnt受體Frizzled的膜穩(wěn)定性,并參與E3泛素連接酶的募集 [8]。
核內β-catenin與TCF/LEF復合物結合后,可上調MYC、CCND1和AXIN2等靶基因轉錄,調節(jié)細胞增殖與分化。此外,β-catenin/TCF復合物還能結合LGR5啟動子上的TCF結合元件,形成正反饋環(huán)路,持續(xù)放大信號通路活性 [9]。
表觀遺傳調控同樣參與LGR5相關信號激活。ChIP測序結果顯示,LGR5高表達細胞中H3K27ac修飾富集,DNA甲基轉移酶DNMT1活性下降,導致染色質開放及Wnt靶基因活化[8]。靶向Porcupine的抑制劑LGK974可阻斷Wnt配體分泌,有效抑制LGR5陽性腫瘤干細胞自我更新,目前已進入臨床試驗 [9]。
3.2 與其他信號通路的交叉調控
除經典Wnt通路外,LGR5還與多條信號網絡存在交互。在脂代謝方面,LGR5影響PPARγ的表達,調控脂肪細胞分化與能量代謝平衡 [2]。在氧化應激下,LGR5可通過調節(jié)FoxO1的核轉位影響抗氧化酶表達,維持基因組穩(wěn)定性。
此外,LGR5還與Notch通路、TGF-β信號及非經典Wnt/PCP途徑存在交互調控。病毒感染狀態(tài)下,LGR5表達變化可干擾Notch靶基因Hes1的轉錄活性,影響細胞分化進程。在結直腸癌中,LGR5高表達通過RSPO增強Wnt信號傳導,并通過表觀遺傳機制沉默抑癌基因,形成正反饋環(huán)路 [7][8]。LGR5與TGF-β/Smad通路的互作則可促進上皮-間質轉化,增強腫瘤侵襲性。這些交叉機制凸顯了LGR5作為信號樞紐的多功能性。
4. LGR5信號異常與疾病關聯(lián)
LGR5信號異常與多種疾病密切相關。在結直腸癌中,LGR5通過Wnt/β-catenin通路過度激活促進腫瘤干性維持,其高表達與腫瘤復發(fā)、轉移及耐藥顯著相關 [7]。LGR5陽性細胞通過穩(wěn)定β-catenin核轉位上調c-Myc、Cyclin D1等基因,驅動細胞周期異常和上皮-間質轉化 [5]。表觀遺傳分析表明,LGR5啟動子去甲基化是其高表達的重要原因 [8]。
在代謝性疾病中,LGR5與脂代謝通路交叉調控,阻塞性睡眠呼吸暫停(OSA)患者中LGR5與脂質代謝紊亂顯著相關,可能通過FoxO信號影響氧化應激反應 [2]。在心血管系統(tǒng)中,LGR5異常表達會影響血管生成與內皮功能,提示其在多種慢性疾病中具有潛在靶向價值。
5. LGR5在腫瘤與其他疾病中的研究進展
5.1 在結直腸癌中的作用
LGR5作為腫瘤干細胞標志物,在結直腸癌中通過激活Wnt信號促進腫瘤細胞增殖、遷移與化療耐藥 [7]。LGR5–RSPO復合物通過抑制RNF43/ZNRF3延長Wnt信號激活,誘導β-catenin核轉位及下游c-Myc、Cyclin D1轉錄 [5]。
結直腸癌微環(huán)境中,LGR5與PI3K/AKT通路協(xié)同調控代謝重編程,增強脂肪酸攝取以滿足能量需求 [2]。LGR5+細胞常富集于腫瘤前沿區(qū),與EMT標志物N-cadherin、vimentin共表達,推動轉移發(fā)生 [11]。動物實驗表明,LGR5敲除可顯著抑制腫瘤生長與轉移,并增強5-FU敏感性 [7]。
靶向治療策略包括阻斷RSPO/LGR5相互作用的單克隆抗體、Wnt下游小分子抑制劑及表觀遺傳調控藥物。抗LGR5抗體偶聯(lián)藥物(ADC)能特異性清除腫瘤干細胞,與PD-1抑制劑聯(lián)合時可顯著增強免疫反應 [5]。此外,HDAC抑制劑通過染色質重塑下調LGR5表達,逆轉耐藥表型 [10]。LGR5靶向CAR-T療法已進入Ⅰ期臨床,其主要挑戰(zhàn)在于避免對正常腸道干細胞的毒性作用 [11]。
5.2 在其他疾病中的作用
在阻塞性睡眠呼吸暫停(OSA)中,LGR5通過調控脂代謝參與疾病進程。患者外周血單核細胞中LGR5表達升高,與甘油三酯及低密度脂蛋白水平呈正相關 [2]。單細胞RNA測序發(fā)現(xiàn),OSA患者呼吸道組織中LGR5+細胞富集,表現(xiàn)出增強的炎癥與氧化應激反應 [12]。
在肝臟疾病中,LGR5陽性肝前體細胞的異常增殖與肝纖維化及肝癌發(fā)生密切相關。斑馬魚肝腫瘤模型顯示,LGR5激活Wnt信號促進肝星狀細胞活化及膠原沉積 [13]。臨床樣本分析顯示,LGR5在肝硬化組織中較正常肝升高3–5倍,且與疾病嚴重程度正相關 [13][14]。
此外,LGR5陽性干細胞耗竭與衰老密切相關。老年腸道類器官中LGR5表達下降伴隨增殖能力減弱;在阿爾茨海默病模型中,LGR5下調導致神經再生受損和認知衰退 [12];皮膚研究表明,LGR5陽性毛囊干細胞減少與皮膚老化特征直接相關。
6. 以LGR5為靶點的藥物開發(fā)進展
目前,針對LGR5的藥物開發(fā)主要集中于抗體藥(雙抗、ADC)及細胞治療(CAR-T)藥物上。適應癥以結直腸癌為主。最高研發(fā)階段為臨床3期,Petosemtamab,也是此次收購的重要標的。其余在研管線總結如下表:
| 藥物 | 作用機制 | 藥物類型 | 在研適應癥 | 在研機構 | 最高研發(fā)階段 |
|---|---|---|---|---|---|
| Petosemtamab | EGFR拮抗劑 | LGR5拮抗劑 | 雙特異性抗體 | 復發(fā)性頭頸部鱗狀細胞癌 | 轉移性頭頸部鱗狀細胞癌 | 晚期惡性實體瘤 | 食管癌 | 胃食管交界處癌 | 轉移性結直腸癌 | 非小細胞肺癌 | Merus NV | 臨床3期 |
| CNA-3103 | LGR5拮抗劑 | 免疫細胞毒性 | T淋巴細胞刺激劑 | 自體CAR-T | 轉移性結直腸癌 | 結直腸癌 | 血液腫瘤 | 卵巢癌 | Carina Biotech Ltd. | Bionomics Ltd. | 臨床1/2期 |
| R462-CPT2 | LGR4抑制劑 | LGR5拮抗劑 | LGR6 antagonists | 多肽偶聯(lián)藥物(PDC) | 結直腸癌 | The University of Texas Health Science Center at Houston | 臨床前 |
| LGR5靶向CAR-T(Adelaide) | LGR5拮抗劑 | CAR-T | 結直腸癌 | University of Adelaide | Carina Biotech Ltd. | 臨床前 |
| 8F2-SG3199 | DNA抑制劑 | LGR5拮抗劑 | ADC | 神經母細胞瘤 | UTHealth Houston | The University of Texas Health Science Center at Houston | 臨床前 |
| R20-SG3199 | DNA抑制劑 | LGR5拮抗劑 | ADC | 神經母細胞瘤 | The University of Texas Health Science Center at Houston | 臨床前 |
| LGR5-ADC(University of Texas Health Science Center) | LGR5拮抗劑 | ADC | 結直腸癌 | The University of Texas Health Science Center at Houston | 臨床前 |
(數(shù)據(jù)截止到2025年10月25日,來源于synapse)
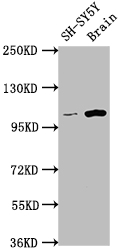
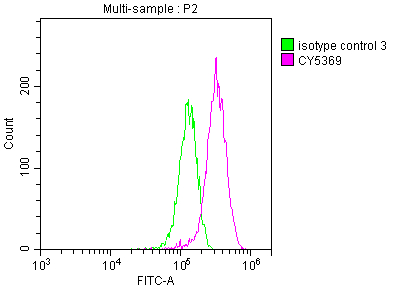
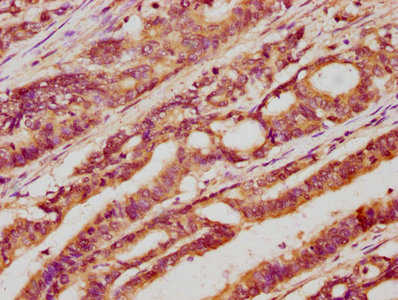
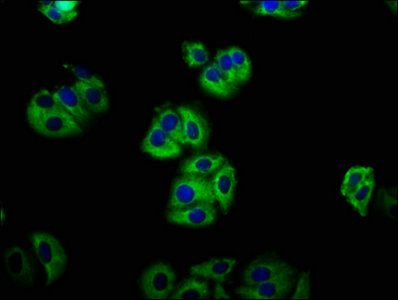
7. 華美生物LGR5研究相關產品
參考文獻:
[1] Kaavya Krishna Kumar1,Antony W Burgess,Jacqueline M Gulbis. Structure and function of LGR5: an enigmatic G-protein coupled receptor marking stem cells[J]. Protein Sci, 2014, 5.
[2] Peng Lü, Xiaodi Wang, Dan Bing. Identification and Validation of Prognostic Factors of Lipid Metabolism in Obstructive Sleep Apnea[J]. Frontiers in Genetics, 2021, 12.
[3]Sang-Myung Jung, Seonghun Kim. In vitro Models of the Small Intestine for Studying Intestinal Diseases[J]. Frontiers in Microbiology, 2022, 12.
[4] Hong Ouyang, Jeffrey L. Goldberg, Shuyi Chen, Wei Li, Guo-Tong Xu, Wei Li, Kang Zhang, Robert B. Nussenblatt, Wei Li, Ting Xie, Chi‐Chao Chan, Donald J. Zack. Ocular Stem Cell Research from Basic Science to Clinical Application: A Report from Zhongshan Ophthalmic Center Ocular Stem Cell Symposium[J]. International Journal of Molecular Sciences, 2016, 17(3): 415-415.
[5] Jia Bian, Marius Dannappel, Chunhua Wan, Ron Firestein. Transcriptional Regulation of Wnt/β-Catenin Pathway in Colorectal Cancer[J]. Cells, 2020, 9(9): 2125-2125.
[6] Clémence Bonnet, Anvi Brahmbhatt, Sophie X. Deng, Jie Zheng. Wnt signaling activation: targets and therapeutic opportunities for stem cell therapy and regenerative medicine[J]. RSC Chemical Biology, 2021, 2(4): 1144-1157.
[7] Hui Zhao, Tianqi Ming, Shun Tang, Shan Ren, Han Yang, Maolun Liu, Tao Qiu, Haibo Xu. Wnt signaling in colorectal cancer: pathogenic role and therapeutic target[J]. Molecular Cancer, 2022, 21(1).
[8] Ankita Sharma, Rafeeq Mir, Sanjeev Galande. Epigenetic Regulation of the Wnt/β-Catenin Signaling Pathway in Cancer[J]. Frontiers in Genetics, 2021, 12.
[9] Dario Zimmerli, George Hausmann, Claudio Cantù, Konrad Basler. Pharmacological interventions in the Wnt pathway: inhibition of Wnt secretion versus disrupting the protein–protein interfaces of nuclear factors[J]. British Journal of Pharmacology, 2017, 174(24): 4600-4610.
[10] Bing Liang, Yanhong Wang, Jiazhen Xu, Yingchun Shao, Dongming Xing. Unlocking the potential of targeting histone-modifying enzymes for treating IBD and CRC[J]. Clinical Epigenetics, 2023, 15(1).
[11] Yagmur Azbazdar, Mustafa Karabicici, Esra Erdal, Günes ?zhan. Regulation of Wnt Signaling Pathways at the Plasma Membrane and Their Misregulation in Cancer[J]. Frontiers in Cell and Developmental Biology, 2021, 9.
[12] Hina Agraval, Hong Wei Chu. Lung Organoids in Smoking Research: Current Advances and Future Promises[J]. Biomolecules, 2022, 12(10): 1463-1463.
[13] Qizhuan Lin, Libo Jin, Renyi Peng. New Progress in Zebrafish Liver Tumor Models: Techniques and Applications in Hepatocellular Carcinoma Research[J]. International Journal of Molecular Sciences, 2025, 26(2): 780-780.
[14] Yaqi Li, Peiyuan Tang, Sanjun Cai, Junjie Peng, Guoqiang Hua. Organoid based personalized medicine: from bench to bedside[J]. Cell Regeneration, 2020, 9(1)

-WB.jpg)
-AC1.jpg)